„Ich bin total im Stress!“ – wer hat das nicht schon oft gehört. Lernstress vor Prüfungen, Termindruck im Job, Social Media – manchmal wird es einfach zu viel. Aber was passiert da eigentlich in unserem Körper? Warum fühlen sich manche Menschen gestresster als andere? Und: Wie bleibt man mental gesund? Mathias V. Schmidt vom Max-Planck-Institut für Psychiatrie spricht mit Wissenschaftsjournalistin Alice Lanzke über Erkenntnisse aus der Stressforschung.
Audiodatei | 20 min, August 2025
© MPG / CC BY-NC-ND 4.0
„Ich bin total im Stress!“ – wer hat das nicht schon oft gehört. Ob in Schule, Studium oder Beruf: Lernstress vor Prüfungen, Termindruck im Job und manchmal sogar Freizeitstress, wenn man sich unter der Woche zu viel vorgenommen hat. Stress hat in unserer Gesellschaft ein ausgesprochen schlechtes Image. Zu Recht? „Ohne Stress wäre unser Leben ziemlich langweilig“, sagt der Biologe Mathias V. Schmidt vom Max-Planck-Institut für Psychiatrie in München. „Wir könnten unseren Alltag gar nicht bewältigen, wenn es keinen Stress gäbe und wir kein funktionierendes Stresssystem hätten.“
Stress ist also per se nichts Negatives. Das Stresshormon Cortisol etwa hilft uns dabei, morgens überhaupt aufstehen zu können – zu diesem Zeitpunkt ist die Cortisol-Konzentration im Blut erhöht. Sie sorgt dafür, dass wir mit Energie in den Tag starten. Abends sinkt sie wieder, damit wir zur Ruhe kommen. „Im Grunde helfen uns Stressreaktionen dabei, die ganz normalen Herausforderungen des Alltags zu bewältigen. Stress gehört zum Leben dazu“, sagt Mathias V. Schmidt. Problematisch wird es, wenn wir zu viel Stress haben – und zwar in Bezug auf Intensität und Dauer (Abb. A). Hält Stress zu lange an, kann unser Stoffwechsel nicht mehr in den Normalzustand zurückkehren. Ein solcher Dauerstress kann krank machen und psychische Erkrankungen wie zum Beispiel Depressionen auslösen. Auch besonders intensiver Stress, etwa durch traumatische Erlebnisse, kann zu solchen Erkrankungen führen. Mathias V. Schmidt untersucht unter anderem an Mäusen, wie verschiedene Arten von Stress auf Säugetiere wirken. Mäuse sind dafür gut geeignet, weil ihr Stresshormon-System und die Rezeptoren – die Andockstellen für Stresshormone in ihrem Gehirn – denen des Menschen sehr ähnlich sind. In seiner Forschung hat der Biologe unter anderem herausgefunden, dass sozialer Stress bei Mäusen einer der stärksten Stressoren überhaupt ist.

Abb. A: Ursachen von Stress. Auszug einer Befragung von volljährigen Personen in Deutschland im Frühjahr 2021: Große Stressfaktoren sind – wie schon vor der Corona-Pandemie – das Pensum an Anforderungen von Schule, Studium und Beruf sowie hohe Ansprüche an sich selbst. Stark an Bedeutung gewonnen hat durch die Pandemie die Sorge um erkrankte Nahestehende. Weitere Ursachen siehe Quelle.
© Quelle Zahlen: Techniker Krankenkasse (TK-Stressstudie, 2021); Grafik: HNBM
Sozialer Stress macht Mäuse vor allem dann krank, wenn er sich nicht kontrollieren lässt und unerwartet auftritt. Experimente lassen sich zum Beispiel so konstruieren, dass eine Maus bei Auseinandersetzungen immer verliert. Experten sprechen von „social defeat“ – „sozialer Niederlage“. Eine solche Maus entwickelt zwar keine Depression, zeigt aber krankhafte Veränderungen. So kann sie zum Beispiel apathisch oder fettleibig werden. Diese Ergebnisse seien auf den Menschen übertragbar, betont Schmidt: „Auch beim Menschen wirkt vor allem jener Stress besonders stark, der unkontrollierbar und unberechenbar ist, zum Beispiel bei Mobbing, das Menschen auf Dauer krank machen kann.“ Ein anderes Beispiel sei die Corona-Pandemie gewesen. Zu Beginn der Pandemie im Frühjahr 2020 war noch unklar, wie gefährlich der Erreger ist und wie man sich wirkungsvoll dagegen schützen kann. Die Menschen fühlten sich ständig einer unberechenbaren Gefahr ausgesetzt. „Durch diesen chronischen Stress hat die Zahl depressiver Symptome damals messbar zugenommen“, erklärt der Max-Planck-Forscher (Abb. B). Als dann die ersten Impfstoffe auf den Markt kamen und klar wurde, wie man sich schützen kann, nahm der Stress wieder ab. „Kontrollierbaren Stress können wir Menschen deutlich besser bewältigen.“ Prüfungsstress kann man beispielsweise minimieren, indem man frühzeitig beginnt, den Lernstoff in kleine Einheiten aufteilt und einen Zeitplan erstellt. Durch Simulieren der Prüfungssituation gewinnt man an Sicherheit. Zu bedenken ist aber auch, dass jeder Mensch anders auf Stressoren reagiert“, so der Wissenschaftler.
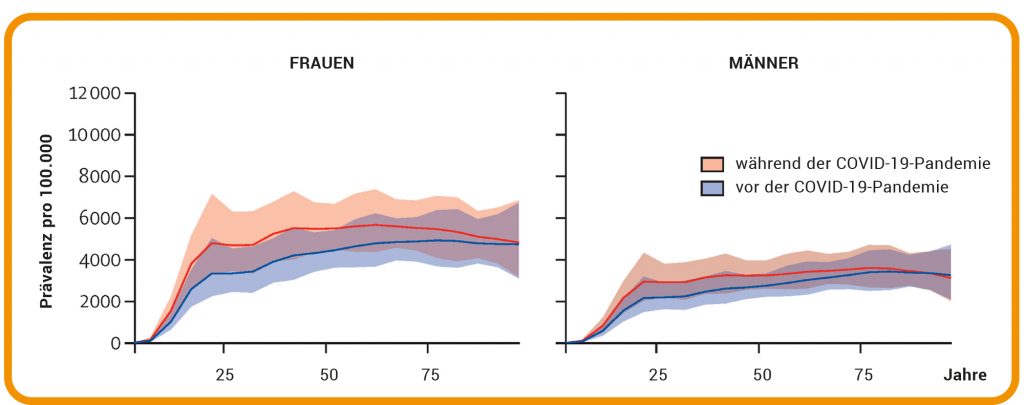
Abb. B: Mögliche Folgen von unkontrollierbarem Stress. Globale Prävalenz von schweren depressiven Störungen vor und während der COVID-19-Pandemie nach Alter und Geschlecht.
© Quelle: Lancet 2021; 398: 1700–12, Fig. 1 (Auszug); https://doi.org/ 10.1016/S0140-6736(21)02143-7 / CC BY 4.0
Anhaltender, unkontrollierbarer Stress und traumatische „Stresserlebnisse“ können also zu einer Depression führen. Welche Mechanismen dahinterstecken und welche Veränderungen im Stoffwechsel Depressionen auslösen, hat man bisher aber nur zum Teil verstanden. Vor 50 Jahren gingen Fachleute noch davon aus, dass Depressionen einzelne, klare Auslöser hätten. Gemäß dieser Vorstellung habe die Erkrankung ihre Ursache in veränderten biochemischen „Pfaden“ (engl. pathways), also einzelnen, klar umrissenen Stoffwechselwegen. Inzwischen ist die Forschung deutlich weiter: Tatsächlich können Depressionen viele verschiedene biologische Auslöser haben. Etwa ein Drittel des Risikos, an einer Depression zu erkranken, ist auch genetisch bedingt – Genomanalysen von Menschen mit Depressionen haben gezeigt, dass viele Gene an der Entstehung einer Depression beteiligt sind. Dieses genetische Risiko spielt mit den Risiken durch Stress zusammen, und könnte zum Teil erklären, warum Menschen resilient oder weniger resilient gegenüber Stresserfahrungen sind.
Ein Forschungsteam am Max-Planck-Institut für Psychiatrie ist genau dieser Frage nachgegangen, welche genetischen Varianten an der Reaktion auf Stress und dem Risiko, eine psychiatrische Störung zu entwickeln, beteiligt sein könnten. Dazu nutzten sie eine Substanz namens Dexamethason, die ähnlich wirkt wie das Stresshormon Cortisol und ebenso wie dieses eine molekulare und zelluläre Antwort, beginnend auf der Ebene der DNA, auslöst. Das Team untersuchte Zellen, die besonders empfindlich auf Stress reagieren. Dabei fanden sie über 500 Stellen im Erbgut (sog. Loci), die Reaktionen auf Stress zeigten, sowie 79 genetische Varianten, die die Expression von Genen und somit die molekulare Antwort auf Stress nur bei Behandlung mit Dexamethason beeinflussten. Diese Varianten stehen, wie große internationale Studien gezeigt haben, auch im Zusammenhang mit dem Risiko, eine psychiatrische Störung zu entwickeln.
Um herauszufinden, wie die Kombination der Varianten dieses Risiko beeinflusst, unterzog das Forschungsteam die Teilnehmenden der Studie einer Stressaufgabe. Dabei zeigte sich, dass eine höhere Anzahl dieser „stressreaktiven“ Genvarianten mit einem Anstieg des Cortisolspiegels bei den entsprechenden Probanden verbunden war. Dieser Unterschied wurde vor der Stressaufgabe nicht beobachtet, was heißt, dass diese Varianten nur in Stresssituationen von Bedeutung waren. Personen mit vielen dieser Genvarianten konnten ihr Stresshormon-System nach der Aufgabe nicht wieder schnell normalisieren und waren dadurch „unnötig“ lange gestresst. So zeigte ein weiterer Test, dass Personen mit mehr Risikovarianten bei Erschrecken intensiver reagierten und sich die Stärke der Schreckreaktion auch nach Wiederholen des Schreckreizes noch erhöhte. „Dabei hätte man eigentlich ein verringerte Reaktionen durch Gewöhnung erwartet“, erklärt Elisabeth Binder, Direktorin am Max-Planck-Institut für Psychiatrie.
„Die Genetik hat also einen Einfluss auf die Empfindlichkeit unserer Reaktion auf Stress. Der molekulare Mechanismus könnte erklären, warum belastende Lebensereignisse mal mehr oder weniger mit psychiatrischen Störungen korrelieren“, fasst Binder die Ergebnisse zusammen. Diese Erkenntnisse seien wichtig für die Vorhersage, welche Menschen ein höheres Risiko haben, als Reaktion auf Stress psychiatrische Störungen zu entwickeln, so die Forscherin weiter. Das könnte helfen, frühzeitig Hilfen anzubieten, um die Entwicklung von psychiatrischen Störungen zu vermeiden.
In zahlreichen Forschungsprojekten wird nach neuen Therapieansätzen für psychiatrische Störungen gesucht. Im Fokus der Untersuchungen steht dabei jenes Stresshormon-System, das unsere Anpassung an Stresssituationen koordiniert, die sogenannte Hypothalamus-Hypophysen-Nebennieren-Achse (HPA-Achse). Eine wichtige Schaltstelle in diesem System ist der Glukokortikoid- Rezeptor. Er kommt in nahezu allen Zellen vor und reguliert dort die Genexpression. Aber erst wenn das Stresshormon Cortisol an den Rezeptor bindet, kann dieser an die entsprechenden Kontrollstellen auf der DNA binden (Abb. C) und so die Transkription und damit die Biosynthese vieler verschiedener Proteine anstoßen, die für die Stressreaktion wichtig sind.
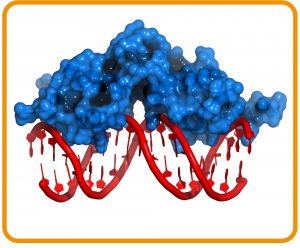
Abb. C: Schaltstelle für Stress. Glucocorticoid-Rezeptor (DNA-Bindungsdomäne), gebunden an einen DNA-Doppelstrang.
© molekuul.be / Adobe Stock
Die Empfindlichkeit des Glukokortikoid-Rezeptors gegenüber Cortisol wird durch eine Reihe von Molekülen, sogenannte Chaperone und Co-Chaperone moduliert. Chaperone beeinflussen die Aktivität anderer Proteine, indem sie diese bei der Faltung in ihre dreidimensionale Struktur unterstützen. Sie sind in verschiedenen Zelltypen und bei verschiedenen Proteinen aktiv. Das Chaperon mit dem Kürzel FKBP51 ist von besonderem Interesse, denn es setzt die Cortisol-Bindefähigkeit des Glukokortikoid-Rezeptors herab. Auf diese Weise sorgt es dafür, dass die Stressreaktion des Körpers wieder heruntergefahren wird, wenn der äußere Stress nachlässt, eine bedrohliche Situation beispielsweise vorüber ist. Das ist ein ganz natürlicher und wichtiger Mechanismus. Genomanalysen bei Menschen mit Stress-bedingten psychiatrischen Erkrankungen, wie der posttraumatischen Belastungsstörung (PTBS) und Depressionen, haben gezeigt, dass bei manchen von ihnen Veränderungen an genau jenem Gen vorliegen, das für das Chaperon FKBP51 kodiert. Möglicherweise wird FKBP51 deshalb vermehrt synthetisiert und dämpft den Glukokortikoid-Rezeptor dauerhaft. Das könnte, so die Annahme, bei depressiven Menschen zu Antriebslosigkeit und Niedergeschlagenheit führen. Auch Veränderungen der Interaktionen des Chaperons mit anderen für Nervenzellen wichtigen Proteinen könnten eine Erklärung dafür sein, warum manche Menschen mehr oder weniger stressresistent sind.
Chaperone sind ein hochinteressanter, potenzieller Angriffspunkt (engl. target) für neue Medikamente und damit verbunden die Therapie depressiver Menschen. Derzeit werden erste Chaperon-Antagonisten entwickelt, die die Aktivität der Chaperone oder deren Biosynthese hemmen. Die Herausforderung dabei: Es gibt viele verschiedene Chaperone, die in ganz verschiedenen Zellen und Geweben aktiv sind und die ganz unterschiedliche Stoffwechselreaktionen steuern. Das bedeutet, dass Chaperon-Antagonisten im Körper sehr gezielt in die für die Stressreaktion zuständigen Zellen eingeschleust werden müssten. Wie sich eine solche gezielte Form des „drug delivery“ technisch umsetzen ließe, ist noch Gegenstand der Forschung.
Aber es sind nicht immer die Gene, die dazu führen, dass manche Menschen nach einem traumatischen Erlebnis eine Depression entwickeln, während andere Menschen mit gleicher Erfahrung nicht erkranken. Tatsächlich spielen auch epigenetische Prozesse eine zentrale Rolle: Sie verändern beispielsweise das Muster der Methylgruppen an der DNA und damit die Aktivierbarkeit bestimmter Gene in bestimmten Zellen oder Organen (s. Biomax 23). So prägt die Epigenetik auch unser Stresssystem. Frühkindlicher Stress beispielsweise kann sich langfristig auf die psychische Gesundheit auswirken und das Risiko für die Entwicklung von Angststörungen und einer posttraumatischen Belastungsstörung erhöhen.
„Stress und Trauma in der Kindheit sind ein maßgeblicher Risikofaktor“, betont Elisabeth Binder. So gehen belastende Kindheitserfahrungen mit einem doppelt so hohen Risiko für depressive Störungen und einem 2,7-fach erhöhten Risiko für Angststörungen im Erwachsenenalter einher. Aber: „Ganz ohne Stress kann auch keine Resistenz aufgebaut werden“, betont die Medizinerin. Tatsächlich legt die Stressforschung der vergangenen Jahre nahe, dass Stressresistenz in der frühkindlichen Entwicklung erlernt wird. Durch seine Experimente an Mäusen hat Mathias V. Schmidt herausgefunden, dass es offenbar wichtig ist, in der Kindheit moderaten Stress zu erfahren. „Stresserfahrung ist essenziell, damit die Mäuse „lernen“, mit Stress umzugehen“, sagt Schmidt. Das sei höchstwahrscheinlich auch beim Menschen so. „Wer zum Beispiel überbehütet aufwächst, kann später den Stress, den Konflikte zwangsläufig mit sich bringen, schlechter bewältigen“, so der Forscher.
Dieses „Stress-Lernen“ findet sehr wahrscheinlich ebenfalls zu einem Teil auf der epigenetischen Ebene statt. „Wir gehen heute davon aus, dass das Erlernen von Stress in der frühkindlichen Entwicklung durch die Methylierung gesteuert wird“, sagt der Max-Planck-Forscher. Epigenetische Veränderungen fänden auch an den Histonen statt, jenen Proteinen, um die der DNA-Strang im Zellkern gewickelt ist. Durch Acetylierung der Histone kann die Wicklung verfestigt oder gelockert werden. Auch das beeinflusst, ob bestimmte Gene aktiviert oder unterdrückt werden. Mittlerweile gibt es konkrete Hinweise darauf, dass zahlreiche epigenetische Veränderungen einen Einfluss darauf haben, wie verschiedene Menschen auf Stress reagieren.
Um die Entwicklung psychiatrischer Erkrankungen zu verstehen, müssen somit neben den genetischen Analysen auch die epigenetischen Kodierungen identifiziert werden. Damit tun sich viele neue Wege für Therapien auf. Stress und Depressionen mögen ein komplexes Phänomen sein, doch die jüngsten Erkenntnisse liefern auch viele Ansatzpunkte für neue Medikamente. Schmidt: „Diese Entwicklungen stimmen mich zuversichtlich, dass wir in den nächsten Jahren große Fortschritte beim Verständnis des Stresses und bei der Entwicklung neuer Wirkstoffe gegen Depressionen und andere psychische Erkrankungen machen werden.“
Schau mir in die Augen – Pupillometrie als Diagnoseergänzung
Antriebslosigkeit ist eines der meist beobachteten Symptome der Depression. Ein Forscherteam des Max-Planck-Instituts für Psychiatrie hat herausgefunden, dass die geringere Pupillenreaktion bei Patienten und Patientinnen einen entsprechenden Hinweis darauf liefert. Bei gesunden Menschen erweitern sich die Pupillen bei der Erwartung auf eine Belohnung, wohingegen diese Reaktion bei Personen mit Depressionen weniger aus geprägt ist. Die Pupillenreaktion ist unter anderem ein Marker für die Aktivität im Locus Coeruleus, einer Gehirnstruktur mit der größten Ansammlung noradrenerger Neuronen im zentralen Nervensystem. Sie könnte als ergänzende Methode zur Diagnosestellung eingesetzt werden. Wenn beispielsweise ein Patient starke Beeinträchtigungen in der Pupillenreaktion zeigt, könnten Antidepressiva, die auf das noradrenerge System wirken, effektiver als andere Medikamente sein.
Abbildungshinweise:
Titelbild: © HNBM
Abb. A: © Quelle Zahlen: Techniker Krankenkasse (TK-Stressstudie, 2021); Grafik: HNBM
Abb. B: © Quelle: Lancet 2021; 398: 1700–12, Fig. 1 (Auszug); https://doi.org/ 10.1016/S0140-6736(21)02143-7 / CC BY 4.0
Abb. C: © molekuul.be / Adobe Stock
Abb. im Kasten: © MPI für Psychiatrie
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 40, April 2025; Text: Christina Beck, Tim Schröder; Redaktion: Tanja Fendt

© Thomas Victor
Wie hat sich das Bild von Ötzi durch Erkenntnisse aus der Archäogenetik verändert? Johannes Krause vom Max-Planck-Institut für evolutionäre Anthropologie erklärt die Ergebnisse einer neuen Genomanalyse und weshalb diese unsere Vorstellung von Ötzi revidieren.
Zum Podcast vom 17. August 2023 © detektor.fm / Max-Planck-Gesellschaft
Themen im Podcast [15 min]:
Fundgeschichte und bisherige Erkenntnisse zur Mumie (ab min 00:00) / neue Erkenntnisse zum Genom (ab min 04:00) / Methode: Hochdurchsatz-DNA-Entschlüsselung (ab min 06:50) / genetische Veranlagung für Krankheiten (ab min 08:05) / neue Erkenntnisse zum Aussehen (ab min 10:10) / zukünftige Forschungsfragen (ab min 13:16)
Hintergrundinfos zur Forschung von Johannes Krause
Das passende MAX-Heft: Die Untersuchung alter DNA erklärt der BIOMAX 33.
Traumata können Veränderungen an unserer DNA auslösen. Was diese epigenetischen Veränderungen bewirken, welche Rolle sie bei der Diagnose und Behandlung psychischer Erkrankungen spielen und ob Traumata vererbt werden können, klärt Mirko Drotschmann im Gespräch mit Elisabeth Binder und ihrem Team am Max-Planck-Institut für Psychiatrie.
YouTube-Link: https://youtu.be/3dsejiG6bBo
[Dauer des Videos: 17 min]
Themen im Video:
1) Umwelteinflüsse hinterlassen Spuren in der DNA (ab 2:11)
Chromosomen, DNA, Gene / epigenetische Veränderung in der Zellentwicklung / epigenetische Auswirkungen von Traumata / Resilienz
2) Veränderung fürs Leben (ab 5:20)
DNA-Modifikationen, Histonmodifikation, nicht-kodierende RNA, Genregulation
3) Epigenetik, Traumata und psychiatrische Erkrankungen (ab 7:14)
FKBP5-Gen, posttraumatische Belastungsstörung / individuelles epigenetisches Profil
4) Weitergabe epigenetischer Veränderungen an die nächste Generation (ab 9:36)
Dauer der DNA-Veränderung / Hungerwinter 1944 / IGF2-Gen / Auswirkungen von Traumata der Eltern / Lernen und Epigenetik
5) Fazit (ab 16:15)
Die Aufgabensammlung enthält folgenden Themen:
Rechercheplakat zu Schlüsselbegriffen / Medienauswertung
Unterrichtsmaterial zum Biomax 23
Die Aufgabensammlung enthält folgenden Themen:
Genregulation / Transkriptionsfaktoren / Stammzelltypen
Unterrichtsmaterial zum Biomax 10
Um Cytosinbasen im Genom gezielt zu methylieren, koppeln die Forschenden eine DNA-Methyltransferase mit einer speziellen Version von Cas9 ohne Schneidefunktion (dCas9). Da die Führungs-RNA komplementär zur Zielregion ist, lässt sich die Methyltransferase so gezielt in bestimmte Regionen im Genom lenken. Dort versieht sie die Cytosinbasen mit Methylgruppen. Im Idealfall werden dabei nur bestimmte Cytosine methyliert, während weiter entfernt liegende unverändert bleiben. Mit der Methode erforschen Wissenschaftlerinnen und Wissenschaftler, welche Methylierungen wann und wo für die Regulation bestimmter Gene verantwortlich sind.
© A. Meissner, MPI für molekulare Genetik / CC BY-NC-SA 4.0
Forschende haben Nucleosomen in Bewegung untersucht. Die oben dargestellten statischen Ansichten sind um 90 Grad gedreht und zeigen die DNA (gelb) zusammen mit den unterschiedlichen Histonen H3 (dunkelblau), H4 (hellblau), H2A (rot) und H2B (hellgrün). Die Histonschwänze ragen aus dem Nucleosom heraus. Sie sind flexibel und spielen eine wichtige Rolle bei der Genexpression.
© V. Cojocaru; MPI für molekulare Biomedizin Münster, Utrecht Universität, Babeș-Bolyai-Universität Cluj-Napoca / CC BY-NC-SA 4.0
Ausschnitt aus einem DNA-Molekül, bei dem an beiden Strängen ein Cytosin methyliert ist (gelbe Kugeln). Die DNA-Methylierung spielt eine wichtige Rolle bei der epigenetischen Genregulation und dient dazu, DNA-Abschnitte „stumm“ zu schalten. Neben einzelnen Basen können auch Histone methyliert sein.
© links: HN; rechts: Christoph Bock / beide CC BY-NC-SA 4.0
Als im Jahr 2001 die Entschlüsselung des menschlichen Genoms fertiggestellt wurde, war die Euphorie groß: Mehr als drei Milliarden Buchstaben umfasst unsere DNA, und die waren endlich bekannt. Wenn es jetzt noch gelänge, in diesem Buchstabensalat die entsprechenden Gene ausfindig zu machen, würde man die Details unseres genetischen Bauplans und damit auch die Ursachen etlicher Krankheiten kennen, so die Meinung vieler Forschender. »Im Rückblick waren unsere damaligen Annahmen über die Funktionsweise des Genoms dermaßen naiv, dass es fast schon peinlich ist«, zitierte die ZEIT im Jahr 2008 den Biochemiker Craig Venter, der mit seiner Firma Celera an der Genomentschlüsselung beteiligt war.
Jahrzehntelang galt das Genom als unveränderlicher Bauplan, der bereits bei der Geburt festgelegt ist. Nicht umsonst wurde das Genom als „Buch des Lebens“ bezeichnet, geschrieben mit einem Alphabet aus vier Buchstaben – den Basen Adenin, Guanin, Cytosin und Thymin. Gene waren Schicksal: Sie sollten Aussehen, Persönlichkeit und Krankheitsrisiken bestimmen. Heute wissen wir, dass die in der DNA gespeicherten Informationen keine 1:1 Blaupause für den Organismus sind. Vielmehr stehen unsere Gene in Wechselwirkung mit verschiedenen Faktoren. Dazu gehören auch sogenannte epigenetische Markierungen. Sie dienen dazu, bestimmte Abschnitte der DNA – quasi wie mit einem „bookmark“ – als „lesenswert“ zu markieren, durch Verweise auf weiter entfernt liegende Abschnitte in neue Zusammenhänge zu bringen oder dem Zugriff der Übersetzungsmaschinerie durch eine Art „Passwort-Schutz“ zu entziehen.
Das Ganze darf man wohl als Informationsmanagement bezeichnen. Angesichts der ungeheuren Komplexität des Genoms, insbesondere von Säugetieren, eine absolute Notwendigkeit – aber auch Grundlage für Regulation: Schließlich müssen viele verschiedene Zelltypen koordiniert und aufrechterhalten werden. Und anders als die Buchstaben der DNA unterscheiden sich die epigenetischen Markierungen zwischen unterschiedlichen Arten von Zellen. Zusammengenommen ergeben sie das Epigenom – eine Art Code, der kontextabhängig ausgelesen wird und die Umsetzung der Erbinformation steuert: „Die Epigenetik ist eine zusätzliche Informationsebene, die festlegt, welche Gene potenziell aktivierbar sind“, sagt der Molekularbiologe Alexander Meissner, Direktor am Max-Planck-Institut für molekulare Genetik in Berlin. Gemeinsam mit seinem Team arbeitet er daran, die biochemischen Grundlagen dieser epigenetischen Steuerung zu entschlüsseln. Die Forschenden wollen verstehen, wie Gene an- oder ausgeschaltet werden, was ihre Aktivität verstärkt oder herunterdimmt.
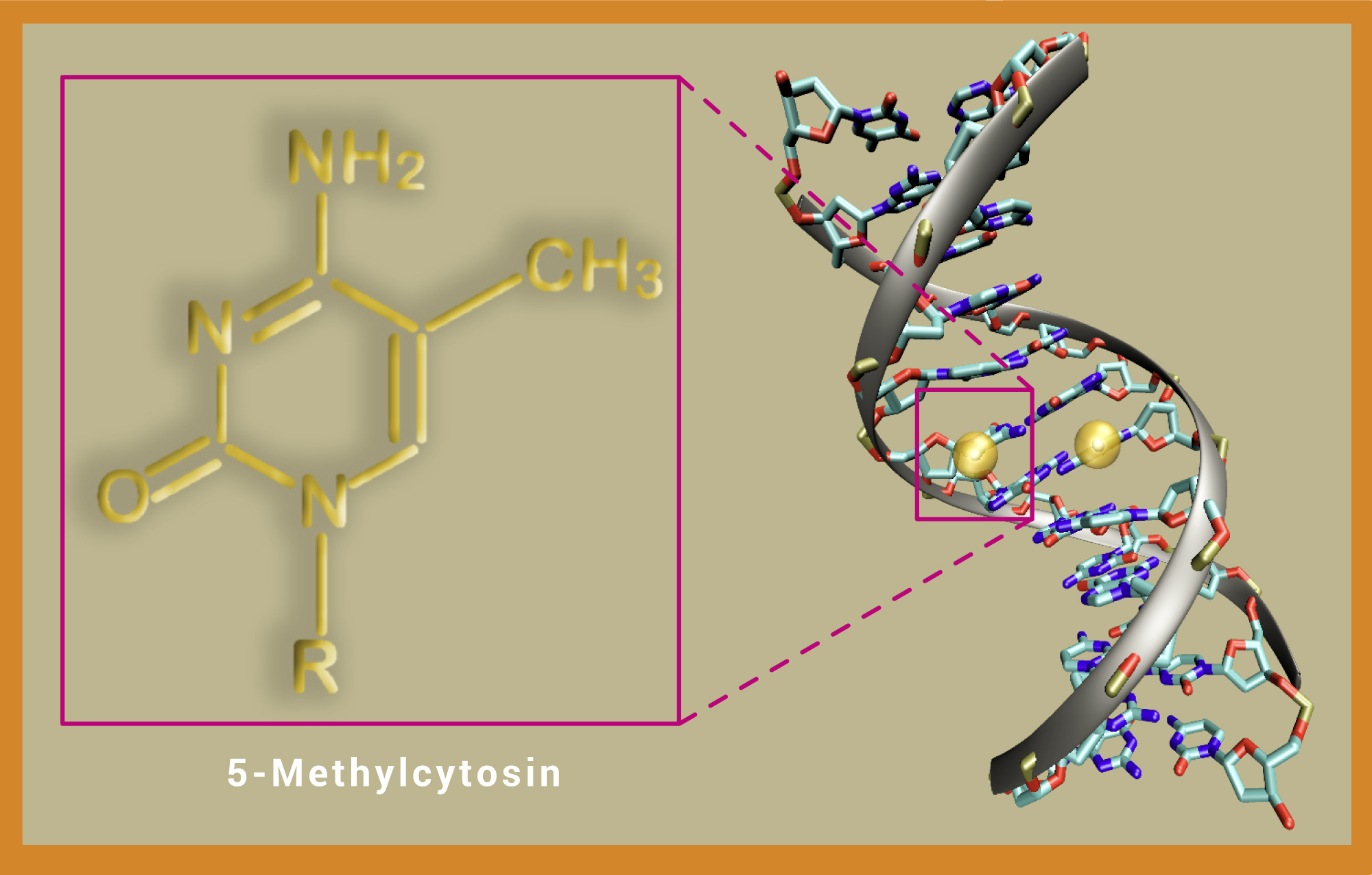
Abb. A: Ausschnitt aus einem DNA-Molekül, bei dem an beiden Strängen ein Cytosin methyliert ist (gelbe Kugeln). Die DNA-Methylierung spielt eine wichtige Rolle bei der epigenetischen Genregulation und dient dazu, DNA-Abschnitte „stumm“ zu schalten. Neben einzelnen Basen können auch Histone methyliert sein.
© links: HN; rechts: Christoph Bock / beide CC BY-NC-SA 4.0
Einer der Regelungsmechanismen setzt direkt an der DNA an: Chemische Markierungen – die Methylgruppen – werden von speziellen Enzymen an die Cytosinbasen der Erbsubstanz angehängt (Abb. A). Die so modifizierten DNA-Abschnitte werden daraufhin nicht mehr ausgelesen und in Proteine übersetzt – das Gen ist „stummgeschaltet“. Eine andere Möglichkeit besteht darin, das „Verpackungsmaterial“ der DNA mit chemischen Markierungen zu versehen. Die rund 3,3 Milliarden Nucleotidbasen des menschlichen Genoms ergeben aneinandergereiht einen Faden, der zwei Meter lang ist! Nur durch geschickte Verpackung ist es möglich, den DNA-Faden im Zellkern unterzubringen. Als „Spulen“ dienen dabei die Histone – spezielle Proteine, um die sich die DNA wickelt (Abb. B). Aus den so entstehenden Histon-DNA-Partikeln (Nucleosomen) ragen die Proteinschwänze der Histone heraus. An diesen Histonschwänzen sitzen bestimmte epigenetische Markierungen, die zahlreiche Eigenschaften des Chromatins kontrollieren. Dazu zählt etwa, ob das Chromatin locker oder dicht gepackt vorliegt. Die unterschiedlich dichte Verpackung reguliert, welche Gene exprimiert werden und damit, welche Proteine eine Zelle produziert.
Damit Enzyme die Erbinformationen lesen und abschreiben können, muss die betreffende DNA-Region für sie zugänglich sein. Zugang finden sie jedoch nur, wenn das Chromatin – etwa durch Acetylierung der Histonschwänze – in lockerer Form als sogenanntes Euchromatin vorliegt. Die zusätzlich angehängten Acetylgruppen heben die positiven Ladungen der Histonschwänze auf. So können die negativ geladenen DNA-Moleküle nicht mehr hin reichend neutralisiert werden, die Chromatinstruktur wird instabil und zugänglicher. Auch eine Phosphorylierung der Histonschwänze verändert durch zusätzliche negative Ladungen den Packungszustand des Chromatins und erleichtert das Ablesen bestimmter DNA- Regionen. Durch Reduktion der Acetylgruppen oder auch durch eine Methylierung der Histone nimmt dagegen die Packungsdichte des Chromatins zu. Damit sinkt die Wahrscheinlichkeit, dass eine DNA-Sequenz abgelesen wird und so ihre Funktion ausüben kann. Forschende bezeichnen solche Bereiche als Heterochromatin.
Ein Schritt bei der Öffnung des Chromatins ist die Bewegung der DNA, während sie in Nucleosomen eingewickelt ist. Wie alle molekularen Strukturen in unseren Zellen sind auch die Nucleosomen recht dynamisch. Sie bewegen sich, drehen sich um die eigene Achse, wickeln sich aus und dann wieder ein. Forschende am Max-Planck-Institut für molekulare Biomedizin in Münster haben mithilfe von Computersimulationen gezeigt, dass zwei Histonschwänze dafür verantwortlich sind, das Nucleosom geschlossen zu halten. Nur wenn diese sich von bestimmten Regionen der DNA wegbewegen, kann sich das Nucleosom öffnen, sodass die DNA für Enzyme zugänglich wird und abgelesen werden kann. Die typischen Bewegungen, mit der sich Nucleosomen öffnen und wieder schließen, bezeichnen Forschende als Nucleosomenatmung.
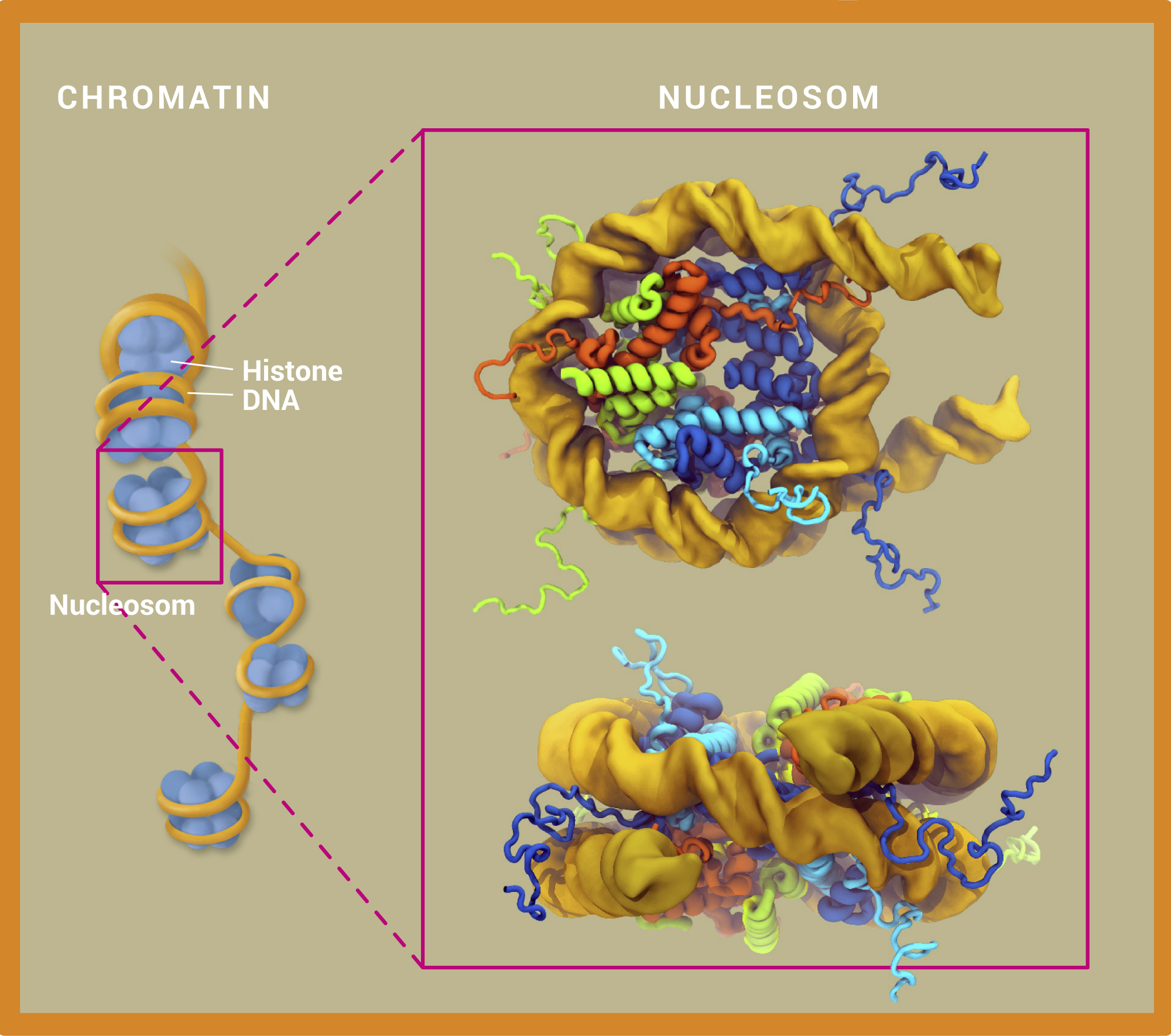
Abb. B: Forschende haben Nucleosomen in Bewegung untersucht. Die oben dargestellten statischen Ansichten sind um 90 Grad gedreht und zeigen die DNA (gelb) zusammen mit den unterschiedlichen Histonen H3 (dunkelblau), H4 (hellblau), H2A (rot) und H2B (hellgrün). Die Histonschwänze ragen aus dem Nucleosom heraus. Sie sind flexibel und spielen eine wichtige Rolle bei der Genexpression.
© V. Cojocaru; MPI für molekulare Biomedizin Münster, Utrecht Universität, Babeș-Bolyai-Universität Cluj-Napoca / CC BY-NC-SA 4.0
Menschen besitzen mehr als 250 verschiedene Zelltypen. Dabei enthalten Hautzellen, Knochenzellen oder Nervenzellen alle dieselbe DNA-Sequenz, obwohl sie ganz unterschiedliche Funktionen erfüllen. Für die Spezialisierung sorgen epigenetische Mechanismen, die den genetischen „Basiscode“ erweitern und die Vielfalt an Expressionsmustern erhöhen: Sie schalten nicht benötigte Gene in bestimmten Zellen stumm, während sie in anderen Zellen aktiv sein können. Alexander Meissner und sein Team vom Max-Planck-Institut für molekulare Genetik in Berlin haben untersucht, wie epigenetische Mechanismen zur Bildung unterschiedlicher Gewebe und Organe im wachsenden Embryo beitragen. Dafür haben sie befruchtete Mäuse-Eizellen mit der Genschere Cas9 (siehe BIOMAX 35) so modifiziert, dass die Enzyme für das Anbringen epigenetischer Markierungen nicht gebildet wurden. Nach einer Entwicklungszeit von sechs bis neun Tagen untersuchten die Forschenden die sich entwickelnden Embryonen. Dabei zeigte sich, dass der Anteil der verschiedenen Zelltypen zum Teil stark verändert war. Von bestimmten Zellen wurden viel zu viele produziert, während andere komplett fehlten. Die Embryonen waren dadurch nicht überlebensfähig. „Wir verstehen jetzt besser, wie epigenetische Regulatoren dafür sorgen, dass wir so viele verschiedene Arten von Zellen im Körper haben“, fasst Meissner die Ergebnisse zusammen. Je nachdem, welche Funktion eine Zelle ausüben soll, versehen Enzyme die DNA mit unterschiedlichen epigenetischen Modifikationen. Sie sorgen dafür, dass sich Stammzellen etwa in Nerven-, Haut-, Herz- oder Muskelzellen weiterentwickeln, sodass sich im wachsenden Embryo unterschiedliche Gewebe und Organe ausbilden.
Epigenetische Mechanismen stecken auch hinter einem Phänomen, das als genomische Prägung bekannt ist und bei verschiedenen Krankheiten eine Rolle spielt: Es tritt bei etwa einem Prozent unserer Gene auf und bewirkt, dass jeweils eine der beiden von den Eltern vererbten Genkopien stummgeschaltet wird. Schädliche Mutationen, die von der Mutter oder dem Vater erworben wurden, können somit nicht durch eine zweite Genkopie ausgeglichen werden. Dies kann zu Krankheiten wie dem Angelman-Syndrom oder dem Prader-Willi-Syndrom, aber auch zu Krebs und Herz-Kreislauf-Erkrankungen führen. Ließe sich das stummgeschaltete gesunde Gen wieder aktivieren, könnte man damit die Störungen des aktiven fehlerhaften Gens möglicherweise ausgleichen. Die Max-Planck-Forschenden wollen daher verstehen, welche Mechanismen für die Inaktivierung der Gene verantwortlich sind. „Erst in den vergangenen Jahren hat sich herauskristallisiert, dass die Prägung auf molekularer Ebene über verschiedene Wege erreicht wird“, sagt Alexander Meissner. Demnach kann auch bei der genomischen Prägung entweder die „Verpackung“ des Erbgutes oder die DNA selbst chemisch modifiziert sein. Um zwischen den verschiedenen Möglichkeiten zu unterscheiden, nutzten die Forschenden wiederum die Genschere Cas9. In befruchteten Mäuse-Eizellen verhinderten sie so die Bildung eines bestimmten Enzyms, das für das Anbringen epigenetischer Markierungen zuständig ist. Anschließend beobachteten sie, ob das fehlgeprägte, stumm geschaltete Gen im weiteren Entwicklungsverlauf wieder aktiv wurde. Auf diese Weise gelang es ihnen nicht nur, die Stummschaltung aufzuheben. Sie konnten auch unterscheiden, welche epigenetischen Mechanismen dahintersteckten. „In den meisten Fällen war das die DNA-Methylierung“, sagt Alexander Meissner.
Neben der Genregulation haben epigenetische Mechanismen auch noch eine andere lebenswichtige Funktion: Indem die Zelle bestimmte DNA-Abschnitte stilllegt, kann sie sich vor „parasitären“ Anteilen des Genoms, den Transposons, schützen. „In den meisten Genomen – auch denen von Menschen und Mäusen – verbergen sich tausende virusähnliche Sequenzen, die sich über die Jahrmillionen im Erbgut ihrer Wirte verewigt haben“, so Meissner. Diese auch als „springende Gene“ bekannten Transposons sind in der Lage, sich spontan zu vervielfältigen und an einer beliebigen Stelle der DNA einzubauen. Transposons haben sich im Genom ausgebreitet und machen etwa 40 Prozent des Erbmaterials in Mäusen und Menschen aus. „Methylierung hält diese potenziell schädlichen Erbgutabschnitte in Schach“, sagt Chuck Haggerty, Wissenschaftler in Meissners Team: „Wenn ein Transposon oder Virus mitten in ein Gen springt, könnte das dessen Funktionen beeinträchtigen.“ Die Zelle muss also unbedingt verhindern, dass sich solche Sequenzen unkontrolliert im Genom ausbreiten. Spezielle Enzyme fahnden daher gezielt danach und heften Methylgruppen als chemische Warnhinweise an. Die so markierten DNA-Abschnitte werden daraufhin von der Zelle ignoriert. Ein solches Enzym aus der Gruppe der Methyltransferasen haben die Berliner Forschenden charakterisiert: Es ist dafür zuständig, den epigenetischen Ist-Zustand aufrecht zu erhalten und kann virusartige Erbgutabschnitte auch gezielt stumm schalten.
Verschiedene Studien haben untersucht was passiert, wenn die für die Methylierung zuständigen Enzyme fehlen. In diesem Fall werden viele invasive Elemente wieder aktiviert, und die Mutationsrate der Zellen schnellt nach oben. Experimente wie diese werfen die Frage auf, ob epigenetische Änderungen möglicherweise das genetische Chaos befördern, das mit Krebserkrankungen einhergeht. Tumorzellen tragen nämlich insgesamt oft zu wenige Methylgruppen am Genom, an bestimmten Stellen jedoch wiederum zu viele. Gene für wichtige Reparaturenzyme oder Schutzmechanismen werden dadurch epigenetisch ausgeschaltet. Möglicherweise ergeben sich daraus aber auch Chancen für die Krebstherapie. Denn während Zellen ihre DNA mit hohem Aufwand vor Mutationen schützen, werden epigenetische Markierungen ständig neu gesetzt oder entfernt. Im Prinzip ließen sich daher Medikamente entwickeln, die ganze Gruppen von Genen über epigenetische Effekte wieder an- oder abschalten.
Alexander Meissner und sein Team wollen daher bestimmte Stellen im Genom gezielt methylieren, um herauszufinden, welchen Effekt die künstlich angebrachten Markierungen haben. Auch dabei kommt ihnen eine umgebaute Version von Cas9 zu Hilfe: Das zentrale Element der Genschere ist Cas9 – ein Enzym, das sich mithilfe von synthetisch hergestellten Führungs-RNAs (Single Guide RNA) gezielt an ausgewählte Regionen im Genom lenken lässt und dort die DNA schneiden kann. Dank der rasanten Entwicklung von Cas9 und ähnlichen Enzymen verfügen Molekularbiologinnen und -biologen heute auch über Cas9-Varianten ohne Schneidefunktion. Genauso wie die schneidende Variante sind auch sie in der Lage, bestimmte Regionen im Genom anzusteuern. Da sie sich darüber hinaus flexibel mit Methyltransferasen koppeln lassen, hoffen die Forschenden, damit künftig gezielt einzelne Basen im Genom methylieren zu können (Abb. C). Dafür müssen die Forschenden aber zuerst noch an den Details tüfteln: „Bisher ist die Methylierung leider noch zu unspezifisch“, sagt Alexander Meissner. Denn während der Enzymkomplex nach seinem Ziel sucht, werden hier und da bereits Methylgruppen angehängt. Der Wissenschaftler ist jedoch zuversichtlich, dass sich die Methylierung noch zielgenauer machen lässt. Die vielen neuen Möglichkeiten, die sich daraus ergeben würden, sind der größte Ansporn für ihn und sein Team: „Es hätte enormes Potenzial, wenn wir das Epigenom auf diese Weise gezielt verändern könnten.“
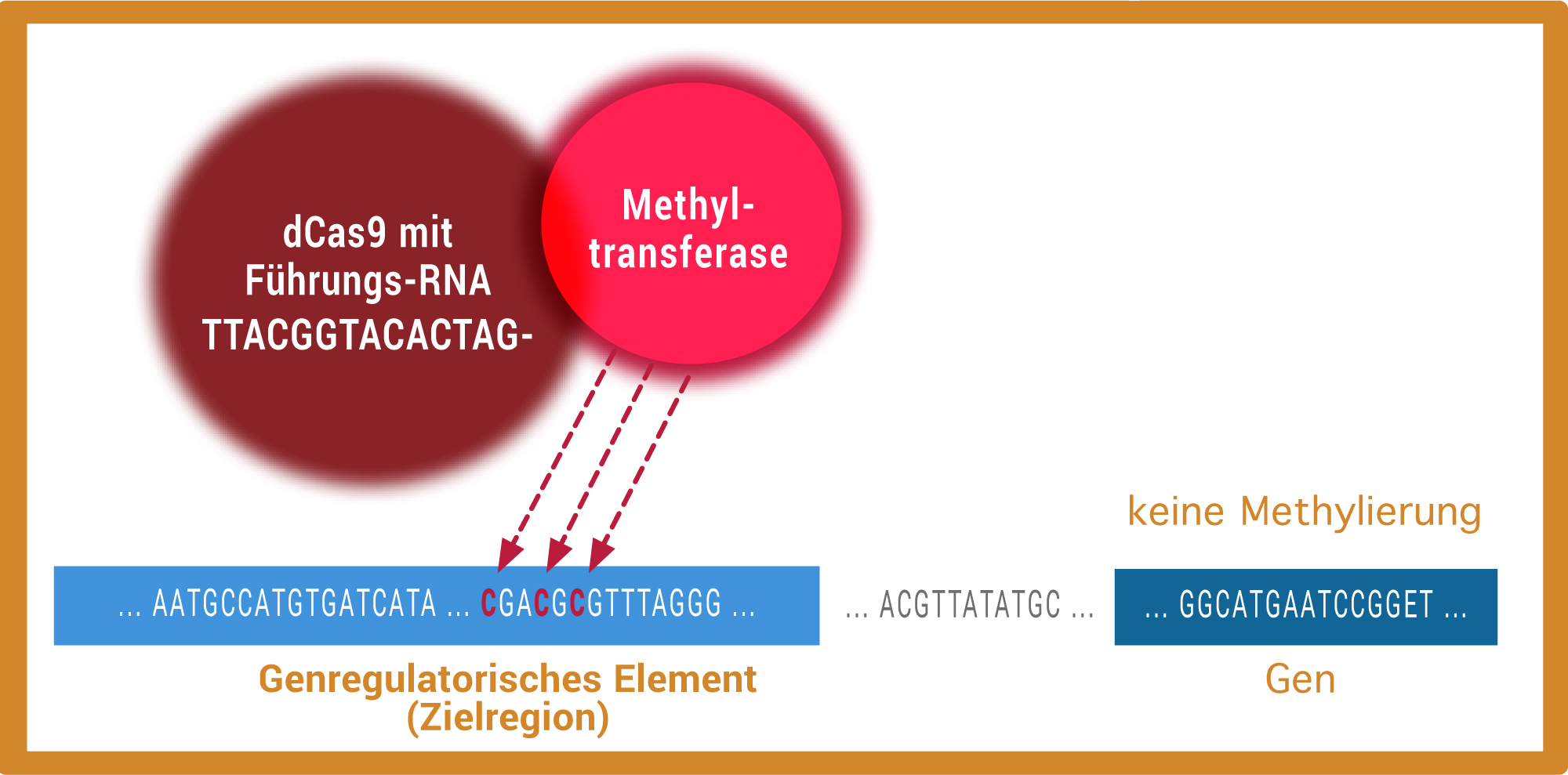
Abb. C: Um Cytosinbasen im Genom gezielt zu methylieren, koppeln die Forschenden eine DNA-Methyltransferase mit einer speziellen Version von Cas9 ohne Schneidefunktion (dCas9). Da die Führungs-RNA komplementär zur Zielregion ist, lässt sich die Methyltransferase so gezielt in bestimmte Regionen im Genom lenken. Dort versieht sie die Cytosinbasen mit Methylgruppen. Im Idealfall werden dabei nur bestimmte Cytosine methyliert, während weiter entfernt liegende unverändert bleiben. Mit der Methode erforschen Wissenschaftlerinnen und Wissenschaftler, welche Methylierungen wann und wo für die Regulation bestimmter Gene verantwortlich sind.
© A. Meissner, MPI für molekulare Genetik / CC BY-NC-SA 4.0
Epigenetische Markierungen können angefügt, aber auch wieder entfernt werden. Dadurch ist das Epigenom im Gegensatz zur DNA-Sequenz relativ flexibel und kann auf Umwelteinflüsse reagieren. Andererseits lassen sich epigenetische Signaturen aber auch konservieren: Während der DNA-Replikation – d.h. bei der Verdopplung der Chromosomen in der teilungsbereiten Zelle – können Methylierungsmuster originalgetreu kopiert werden. Das ermöglicht es, die enthaltenen Informationen von einer Zellgeneration an die nächste weiterzugeben und damit dauerhaft zu speichern. Organismen bauen auf diese Weise ein zelluläres Gedächtnis für Umwelteinflüsse auf. Ob Stress, Ernährung, Sport oder Drogenkonsum – letztlich hinterlässt unsere gesamte Lebensweise Spuren im Epigenom. Zwillingsstudien zeigen dies besonders eindrucksvoll: Eineiige Zwillinge haben exakt die gleichen Gene, trotzdem unterscheiden sie sich in den Mustern ihrer Genaktivität und damit auch in ihren Eigenschaften. Die Unterschiede sind epigenetisch bedingt und nehmen mit dem Lebensalter zu: Während bei dreijährigen Zwillingen die Gene noch nahezu gleich „ticken“, sind die Unterschiede bei 50-jährigen fast viermal so häufig. Besonders ungleich sind jene Pärchen, die schon früh getrennte Wege gehen.
Ein besonders spannendes Gebiet der Molekularbiologie ist derzeit die transgenerationelle Epigenetik, die sich mit der Vererbung epigenetischer Informationen befasst: Immer mehr Studien an so unterschiedlichen Organismen wie Fruchtfliegen, Mäusen und Menschen deuten darauf hin, dass epigenetische Muster nicht nur zwischen verschiedenen Zellgenerationen innerhalb des Körpers weitergegeben werden, sondern zumindest in gewissen Situationen sogar über Generationen hinweg. Demnach können etwa die Ernährungslage während der Schwangerschaft, Traumata, Umweltgifte oder Nikotinkonsum nicht nur das Leben der Kinder bis ins hohe Alter beeinflussen, sondern sogar noch bei den Enkeln und darüber hinaus fortwirken. Inwieweit wir nicht nur unsere Gene, sondern auch epigenetische Veränderungen vererben, muss noch genauer erforscht werden. Es scheint, als könne das Leben unserer Großeltern – das Essen, das sie gegessen haben oder die Erfahrungen, die sie gemacht haben – uns womöglich noch Jahrzehnte später beeinflussen. Und das, obwohl wir selbst diese Dinge nie erfahren haben!
Abbildungshinweise:
Titelbild: © adobestock / HNBM
Abb. A: © links: HN; rechts: Christoph Bock / beide CC BY-NC-SA 4.0
Abb. B: © V. Cojocaru; MPI für molekulare Biomedizin Münster, Utrecht Universität, Babeș-Bolyai-Universität Cluj-Napoca / CC BY-NC-SA 4.0
Abb. C: © A. Meissner, MPI für molekulare Genetik / CC BY-NC-SA 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 23, aktualisiert im Sommer 2022; Autorinnen: Christina Beck, Elke Maier; Redaktion: Tanja Fendt