CC BY 2.0 | NICHD / flickr.com
Bei einem Schlaganfall sterben Neuronen im Gehirn ab. Das Gehirn kann sich zwar nicht selbst reparieren, aber das Netzwerk der Nerven kann sich neu strukturieren und Schlaganfall-Patienten können ihre Sprache zum Teil wiedererlangen. Wissenschaftler des Max-Planck-Instituts für Kognitions- und Neurowissenschaften erforschen, wie man diese Umstrukturierung unterstützen kann.
[6 min; deutsch]
Podcast vom 6. März 2017 © Podcast: detektor.fm
© Martin Westermann
Bakterien sind Einzeller. Wissenschaftler am Max-Planck-Institut für chemische Ökologie stellen dies in Frage. Sie untersuchen, wie Bakterien in spezialisierter Arbeitsteilung komplexere Organismen bilden und sich so gegenseitig versorgen.
[6 min; deutsch]
Podcast vom 8. März 2017 © Podcast: detektor.fm
Weitere Infos zum Thema: Vom Einzeller zum Vielzeller
© Rawpixel
Was wäre, wenn es einen Impfstoff gäbe, der nicht nur perfekt auf den Erreger, sondern auch auf den jeweiligen Menschen abgestimmt wäre? Forscher vom Potsdamer Max-Planck Institut für Kolloid- und Grenzflächenforschung arbeiten daran. Sie wollen mithilfe von Zuckern wirksamere Medikamente und Impfstoffe entwickeln. Davon sollen vor allem ärmere Länder profitieren.
[6 min; deutsch]
Podcast vom 5. Mai 2017 © detektor.fm
Weitere Infos zum Thema: Mit Zucker gegen Krankenhauskeime

© The Amoeba Sisters
„Die Evolution muss außerordentlich zufrieden gewesen sein. So zufrieden, dass sie drei Milliarden Jahre weitestgehend verschlief. Vielleicht blickte sie auch einfach voller Stolz auf ihr Werk, ohne sich zu Höherem berufen zu fühlen. Sicher, dieser Membransack mit dem Supermolekül im Kern hatte sich als Husarenstück erwiesen, auf das man sich durchaus etwas einbilden konnte. Aber dreieinhalb Milliarden Jahre nichts als Einzeller?“ So flapsig und doch treffend zugleich steigt Frank Schätzing in seinem Buch „Nachrichten aus einem unbekannten Universum“ in die Geschichte der Evolution ein. „Eine winzige Hülle, die im offenen Wasser treiben konnte, dabei aber immer alles hübsch beieinander hatte, was zur Erhaltung einer lebensfähigen Zelle vonnöten war. […] Damit war der Grundbaustein aller komplexen Wesen erfunden. Ein kleines Säckchen voll genetischer Information, ein praktischer Beutel. Die Handtasche der Evolution.“
Mehrfach hat sich dieser „Membransack“ entwickelt, mit unterschiedlichen Resultaten. Archaebakterien und Eubakterien, die „echten“ Bakterien, entstanden. Sie bilden zusammen die Familie der Prokaryonten. Karyon ist das griechische Wort für „Kern“, ein Prokaryont ist also eine Zelle vor der Erfindung des Zellkerns. Archaebakterien und Eubakterien enthalten nämlich kein inneres Membransystem und auch ihre DNA liegt als Molekül frei im Plasma der Zelle vor. Oder wie Schätzing schreibt: „In der Handtasche rutschte immer noch alles wild hin und her.“ Die Eukaryonten umfassen die übrigen Lebewesen. Sie unterscheiden sich von den Prokaryonten vor allem darin, dass sie einen echten Zellkern sowie membranumhüllte Organellen besitzen, von denen einige eigene Erbanlagen (Gene) enthalten.
Was genau aber ist passiert, damit aus Prokaryonten Eukaryonten werden konnten – jene Zellen, die als Urväter der drei großen Reiche gelten, der Pilze, Pflanzen und Tiere? Bereits 1867 hatte der Schweizer Botaniker Simon Schwendener erkannt, dass Flechten quasi Doppelorganismen aus Alge und Pilz sind. Sie bestehen aus einem oder mehreren Pilzen, den sogenannten Mycobionten, und einem oder mehreren Photosynthese betreibenden Partnern, den Photobionten. Das sind in der Regel Grünalgen oder Cyanobakterien. Der Pilz bildet fast immer den eigentlichen Vegetationskörper, ein Geflecht aus Pilzfäden (Hyphen); darin eingeschlossen befindet sich eine Population der Photobionten (Abb. A). Die Vorteile der Symbiose liegen stark auf der Seite des Mycobionten: Er wird von seinem Photobionten, der Alge, mit Nährstoffen versorgt, welche diese durch Photosynthese bildet. Schwendener schrieb daher auch von einer „Versklavung“ der eingefangenen Alge durch den Pilz; heute sprechen Forscher eher von „kontrolliertem Parasitismus“.
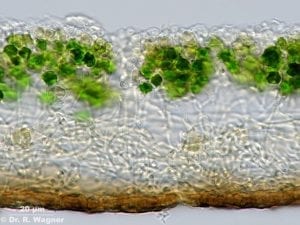
Abb. A: Oben liegt eine Rindenschicht aus dichtem Pilzmycel und darunter folgt eine Schicht mit den symbiontischen Grünalgen. Unter dieser Algenschicht folgt dann lockeres Pilzmycel und den Abschluss nach unten bildet eine braune Rindenschicht, gebildet aus dicht verfilzten Hyphen.
© Dr. R. Wagner
Die Eigenschaften der Flechten unterscheiden sich deutlich von jenen der Organismen, aus denen sie sich zusammensetzen. So bilden sich erst in der Symbiose die typischen Wuchsformen der Flechten heraus, und nur in Lebensgemeinschaft mit einem Photobionten bilden die Mycobionten die charakteristischen Flechtensäuren. Für den russischen Naturforscher Konstantin Mereschkowski lieferten Flechten daher einen ersten Hinweis darauf, dass neue Lebensformen durch Kombination von Einzelorganismen entstehen können. 1905 veröffentlichte er eine erste theoretische Arbeit, „Über Natur und Ursprung der Chromatophoren im Pflanzenreich“, die noch heute als die grundlegende Publikation zur Endosymbiontentheorie gilt. Sie sollte sich als revolutionär erweisen für das Verständnis vom Ursprung eukaryotischen Lebens.
Die Idee war allerdings nicht neu, andere Biologen, u.a. Andreas Schimper, hatten sich bereits in den 1880er-Jahren darüber Gedanken gemacht. Doch erst Mereschkowski legte eine schlüssige Herleitung vor, dass Chloroplasten – jene Organellen, in denen die Photosynthese, also der Aufbau von Glucose aus Kohlendioxid und Wasser im Sonnenlicht, stattfindet – auf ehemals frei lebende Prokaryonten zurückgehen: Sie waren von artfremden, eukaryotischen Wirtszellen aufgenommen, aber nicht verdaut worden, sondern hatten zunächst eine stabile Form der Partnerschaft mit den Wirtszellen gebildet. „Das war der Moment, in dem die Wohngemeinschaft erfunden wurde, wissenschaftlich Endosymbiose. Sozusagen Kommune 1“, schreibt Schätzing.
Ein wichtiges Indiz war für Mereschkowski die Tatsache, dass Chloroplasten immer durch Teilung aus ihresgleichen hervorgehen, und nicht, wie man es von Zellbestandteilen erwarten würde, im Zyklus der Zellteilung neu gebildet werden. Ferner besaßen die blaugrün gefärbten Plastiden auffallende physiologische und morphologische Ähnlichkeiten mit den photosynthetisch aktiven Cyanobakterien. Auch wenn die Beobachtung dieser extrem kleinen Organismen mit Mikroskopen zu dieser Zeit alles andere als einfach war – Mereschkowski war überzeugt: Cyanobakterien besaßen weder einen Kern noch Chloroplasten; das Cyanobakterium als Ganzes war ein einzelner Chloroplast. Auch die gut bekannten Fälle von Symbiose unterstützten seine Behauptung, dass Chloroplasten in Wirklichkeit Cyanobakterien sind. Mereschkowski wies auf Algen (Zoochlorellen und Zooxanthellen) hin, die symbiotisch in Protozoen, Süßwasserschwämmen, Hydra und bestimmten Plattwürmern leben. Symbiotische Algen, so sein Argument, konnten in fast jeder Klasse von „niederen wirbellosen Tieren“ gefunden werden.
Was Mereschkowski noch nicht wissen konnte, haben inzwischen moderne Methoden der Molekularbiologie enthüllt: Studiert man die Struktur von Plastiden (und übrigens auch von Mitochondrien) genau, fällt auf, dass sie sich durch zwei Hüllmembranen gegen das Cytoplasma abgrenzen – als Ergebnis der Phagocytose, also der Einverleibung einer Zelle in eine andere. Dabei ist die äußere Membran typisch eucytisch, die innere hingegen weist protocytische, also bakterielle Merkmale auf. Chloroplasten besitzen eine eigene zirkuläre DNA; DNA-Vervielfältigung und Proteinherstellung ähneln dabei denen von Bakterien. So besitzt die Chloroplasten-DNA bakterienartige Promotoren, das sind jene Sequenzbereiche, welche das Ablesen eines Gens regulieren. Anders als eukaryotische Zellen besitzen Chloroplasten sogenannte 70S-Ribosomen, die auch für Bakterien charakteristisch sind. Und ihre Gene weisen eine hohe Übereinstimmung mit cyanobakteriellen Genen auf.
Es gibt somit eine Fülle von Belegen für die Endosymbiontentheorie, was aber nicht heißt, das nicht auch noch viele Fragen offen wären, insbesondere wie beziehungsweise wie oft und wann genau die verschiedenen Stufen der Endosymbiose stattgefunden haben. Hier liegt noch vieles im Dunkeln. Bezüglich des „Wie oft“ der Chloroplasten-Bildung kann die Wissenschaft immerhin schon sagen, dass alle Chloroplasten (auch die komplexen) der (ein- und mehrzelligen) Algen und Landpflanzen monophyletischen Ursprungs sind, also auf ein einzelnes Endosymbiose-Ereignis zurückgehen. Über das „Wann“ bestand allerdings lange Zeit Uneinigkeit: Die Datierungen für den gemeinsamen Vorfahren aller Eukaryonten gingen weit auseinander – sie variierten zwischen 1,5 und 2,8 Milliarden Jahren.
Die Kluft von mehr als einer Milliarden Jahre tat sich auf zwischen fossilen Funden und chemischen Spuren: Um die Entstehung höherer Lebewesen nachzuvollziehen, haben Wissenschaftler bestimmte Fettmoleküle, sogenannte Steroide, analysiert, die in den Zellwänden eukaryotischer Organismen enthalten sind. Steroid-Moleküle können in altem Sediment, also dem versteinerten Grund urzeitlicher Gewässer, als Sterane erhalten bleiben. Einige Wissenschaftler hatten solche molekularen Spuren vermehrt in Proben von 2,5 bis 2,8 Milliarden Jahre alten Sedimenten identifiziert und daraus geschlussfolgert, dass eukaryotische Algen bereits in dieser Zeit entstanden sein müssen. Andererseits finden sich die ältesten fossilen Mikroalgen, welche unumstritten als Überbleibsel von Eukaryonten gelten, bisher nur in etwa 1,5 Milliarden Jahre altem Gestein im Norden Australiens. Könnten die chemischen Proben kontaminiert gewesen sein?
2015 haben Wissenschaftler des Max-Planck-Instituts für Biogeochemie in Jena zusammen mit US-amerikanischen Kollegen eine neue Methode entwickelt, um 2,7 Milliarden alte Gesteine, die als steroidhaltig eingestuft wurden, auf extrem saubere Weise zu beproben. Die hochempfindlichen Massenspektrometer der verschiedenen Labore konnten nicht einmal Pikogramm-Mengen eukaryotischer Steroide detektieren. „Das gesamte organische Material in diesen Proben wurde im Laufe der Jahrmillionen durch Druck und Temperatur verändert – keine Biomarker-Moleküle hätten dies überlebt“, sagt der Max-Planck-Forscher Christian Hallmann. Somit können die vermeintlich 2,7 Milliarden Jahre alten Steroidmoleküle nicht mehr als Beweis herhalten, dass Eukaryonten bereits viel früher entstanden sind, als Fossilienfunde belegen.
Ohnehin hatten die bisherigen chemischen Daten den Forschern einiges Kopfzerbrechen bereitet: Da alle Eukaryonten Sauerstoff benötigen, muss die Entwicklung der Sauerstoff-produzierenden Photosynthese dem evolutionären Übergang zu den Eukaryonten vorausgegangen sein. Diese biochemische Innovation, bekannt als „Sauerstoff-Krise“, in deren Folge sich der gesamte Planet veränderte, wird eindeutig auf 2,5 bis 2,4 Milliarden Jahre vor unserer Zeit datiert. Bislang ließ sich schwer erklären, wie die Eukaryonten schon mehrere 100 Millionen Jahre vorher entstanden sein konnten, wenn sie doch unbedingt Sauerstoff brauchten.
Inzwischen gibt es weitere Entdeckungen: So haben schwedische Forscher 2017 in Zentralindien die womöglich bisher ältesten Fossilien eukaryotischer Zellen entdeckt. Fündig wurden sie in der rund 1,6 Milliarden Jahre alten Chitrakoot-Formation. Dieses Sediment entstand einst in einem flachen Küstengewässer, in dem Kolonien von fädigen Cyanobakterien lebten. Ihre typischen, röhrenförmigen Relikte sind als Stromatolithen im Gestein erhalten geblieben.
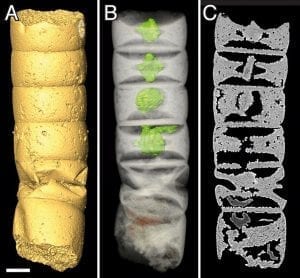
Abb. B: Röntgentomografie eines der fossilen Zellröhrchen (Rafatazmia chitrakootensis), Balken 50 µm: (A) Oberfläche (B) Durchsicht mit rhombischen Strukturen, eingefärbt (C) virtueller Längsschnitt.
© Bengtson et al./PLoS Biology https://doi.org/10.1371/journal.pbio.2000735
Zwischen den fossilen Cyanobakterien entdeckten die Forscher jedoch einige Röhrchen, die mit bis zu zwei Millimetern Länge deutlich größer waren und eine ungewöhnliche innere Struktur besaßen, wie Mikro-Computertomografie-Aufnahmen enthüllten (Abb. B). Die Forscher vermuten, dass es sich bei diesen intrazellulären Strukturen um eine frühe Form von Plastiden handelt. Sollte sich dies bestätigen, wären diese 1,6 Milliarden Jahre alten Mikrofossilien eine der ältesten, wenn nicht der älteste gesicherte Fund eukaryotischer Zellen.
Was als „lockere Wohngemeinschaft“ vor etwa anderthalb Milliarden Jahre begann, führte bei den Symbionten zu einer Co-Evolution, in deren Verlauf diese ihre Autonomie verloren und zu Organellen umgestaltet wurden. Dabei wurden Teile der Symbionten-DNA in das Kerngenom der Wirtszelle integriert (Abb. C). Forscher nehmen an, dass die endosymbiotisch lebenden Cyanobakterien und Proteobakterien (Vorläufer der Mitochondrien) bis zu 90 Prozent ihres Genoms in den Kern der Wirtszelle transferiert haben. Ein solcher funktionaler Gentransfer setzt jedoch voraus, dass die Gene an richtiger Stelle in das Kerngenom eingebaut werden, damit sie abgelesen werden können. Da die Übertragung Tausender Gene aus den Organellen in den Kern in riesigen evolutionären Zeiträumen ablief und demzufolge niemand jemals ein solches Ereignis beobachten konnte, entzog sich diese Frage bislang jeder Überprüfung. „Erst neue Technologien, die es erlauben, Chloroplastengenome höherer Pflanzen gentechnisch zu verändern, haben es uns in den vergangenen Jahren ermöglicht, wichtige Schritte dieses evolutionären Prozesses im Labor – quasi im Zeitraffer – nachzuvollziehen und die molekularen Grundlagen des Gentransfers zwischen Organellen- und Kerngenomen zu analysieren“, erklärt Ralph Bock, Direktor am Max-Planck-Institut für molekulare Pflanzenphysiologie.
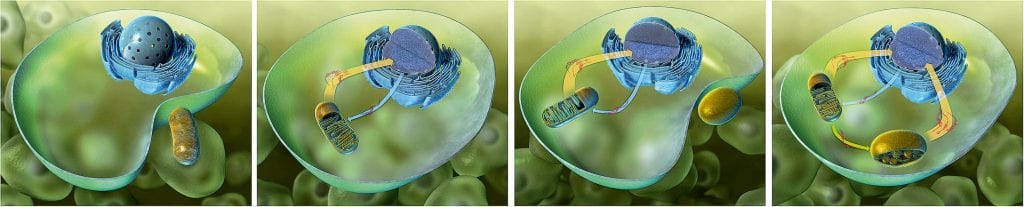
Abb. C: Die Vorläufer der Organellen waren freilebende Bakterien, die von einer „Urzelle“ umschlossen wurden. Auf diese Weise entstanden aus Proteobakterien Mitochondrien und aus Cyanobakterien Chloroplasten. Die Pfeile geben die Richtung und den Umfang des Gentransfers an.
© Jochen Stuhrmann
Der Max-Planck-Forscher und sein Team brachten ein zusätzliches Gen in die Chloroplasten von Tabakpflanzen ein. Dieses Gen vermittelt eine Resistenz gegen das Antibiotikum Kanamycin – allerdings nur dann, wenn es sich im Erbgut des Zellkerns befindet. Folglich konnten die gentechnisch veränderten Pflanzenzellen nur resistent gegen Kanamycin sein, wenn das Gen von den Chloroplasten in den Kern der Zellen eingewandert und dort erfolgreich ins Erbgut integriert worden war. Um das zu testen, überführten die Forscher die Pflanzenzellen in eine Gewebekultur und brachten diese auf einem mit Kanamycin versetzten Nährmedium aus. Zellen, die hier überlebten, mussten das Resistenzgen aus dem Plastidengenom in das Kerngenom transferiert haben. Aus solchen Zellen können schließlich komplette, gegen das Antibiotikum resistente Pflanzen wachsen. „Die Häufigkeit, mit der sich ein solcher Gentransfer vollzogen hat, übertraf alle unsere Erwartungen“, sagt Ralph Bock: „In etwa einer von fünf Millionen Zellen war das Gen in den Zellkern gelangt.“ Wie viel dies ist, wird deutlich, wenn man sich klarmacht, dass ein einziges Blatt aus wesentlich mehr als fünf Millionen Zellen besteht.
Nun führt der Transfer eines Gens aus den Chloroplasten in den Zellkern nicht automatisch zu einem funktionierenden Kern-Gen. Der Grund dafür ist, dass sich prokaryotische, also bakterielle Organellen-Gene und eukaryotische Kern-Gene strukturell unterscheiden. Beim oben beschriebenen Experiment umgingen die Forscher dieses Problem, indem sie das Gen, welches die Kanamycin-Resistenz vermittelt, mit eukaryotischen Steuerelementen (Promotor, Terminator) versahen. Somit war es unmittelbar nach dem Einfügen im Kerngenom auch aktiv. Beim evolutionären Gentransfer ist dies jedoch nicht der Fall: Das transferierte Gen wird zwar in den Zellkern eingebaut, kann dort aber in aller Regel zunächst nicht abgelesen werden – es sei denn, in einem zweiten Schritt wird ein eukaryotischer Promotor vor das Gen eingebaut.
Um zu prüfen, ob ein solches Ereignis ebenfalls stattfindet, haben die Forscher ein weiteres Gen – dieses Mal allerdings mit bakterieller Genstruktur – in das Chloroplastengenom eingeführt, das eine Resistenz gegen das Antibiotikum Spectinomycin vermittelt. Im Zug des Experiments entstanden somit Pflanzen, bei denen sich im Zellkern ein funktionierendes Kanamycin-Resistenzgen nebst einem inaktiven (weil bakteriellen) Spectinomycin-Resistenzgen befand. Folglich sollten diese Pflanzen resistent gegen Kanamycin, aber empfindlich gegenüber Spectinomycin sein. Tatsächlich traten in den Kultivierungsexperimenten in acht selektierten Pflanzenlinien jedoch Resistenzen auch gegen Spectomycin auf, ergo musste das entsprechende Gen aktiv geworden sein. „Es zeigte sich, dass in jedem dieser Fälle durch die Deletion eines kleineren Stücks DNA ein aktiver Promotor vor das Gen gelangt war“, erklärt Bock. Dieser molekulare Umbau reichte aus, um das Spectinomycin-Resistenzgen zu aktivieren. Damit konnten erstmals Vorgänge, die sonst in erdgeschichtlichen Zeiträumen ablaufen, im Zeitraffer nachvollzogen und die zugrunde liegenden Mechanismen aufgeklärt werden. Es ist somit nicht überraschend, dass es verschiedenen Endosymbionten innerhalb weniger Millionen Jahre gelang, einen guten Teil ihres Genoms in den Wirtskern auszulagern und zu aktivieren.
Und wie ging es weiter? „Nun sind Einzeller zwar klein, so klein aber auch wieder nicht. Man hat errechnet, dass eine ungebremste Vermehrung die Erde binnen weniger Tage mit Einzellern regelrecht überzogen hätte. Lückenlos! Die frühe Schöpfung wäre an sich selbst erstickt. […] War die Idee mit der Handtasche doch nicht so genial gewesen?“ Und damit beginnt laut Schätzing „Miss Evolutions dritter Geniestreich“: „Ihr Plan war auf Spezialisierung ausgerichtet. […] Das große Geheimnis der Vielzeller ist, dass sie nicht einfach Zusammenballungen von Mikroben sind, sondern ihre Zellen sich die Arbeit am heranwachsenden Organismus teilen.“ Also sorgte Miss Evolution auch dafür, dass nur ganz bestimmte Zellen zur Fortpflanzung fähig waren. Und jetzt kommt die Sache mit dem Sex – aber das ist eine andere Geschichte.
Abbildungshinweise:
Titelbild: Cartoon Zellen © The Amoeba Sisters
Abb. A: Querschnitt Flechte © Dr. R. Wagner
Abb. B: Eukaryoten-Urahn © Bengtson et al./PLoS Biology https://doi.org/10.1371/journal.pbio.2000735
Abb. C: Pflanzenzellentwicklung © Jochen Stuhrmann
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 34, Winter 2017/2018; Autorin: Christina Beck

Svante Pääbo © Fank Vinken / MPG
Wer sind wir? Woher kommen wir? – das sind zentrale Fragen, die uns Menschen schon seit mehr als einem Jahrhundert beschäftigen. Spätestens seit dem Jahr 1856 als Arbeiter im Neandertal, ungefähr zwölf Kilometer östlich von Düsseldorf, in einem Steinbruch eine kleine Höhle ausräumten und dabei Reste eines Skeletts entdeckten. Über die Zuordnung der Knochenfragmente wurde lange gestritten. Die Einschätzung einiger Anatomen, dass es sich hierbei um eine Frühform des modernen Menschen handle, wurde insbesondere von dem einflussreichen deutschen Pathologen Rudolf Virchow nicht geteilt. Gegen Ende des 19. Jahrhunderts jedoch hatte sich die Auffassung, dass der Neandertaler ein Vorläufer des anatomisch modernen Menschen war, durchgesetzt.
Dank der mehr als 300 Skelettfunde ist der Neandertaler die am besten untersuchte fossile Art der Gattung Homo. Wie ähnlich die Neandertaler uns waren, ob sie einen ausgestorbenen Ast im Stammbaum der Frühmenschen darstellten und ob sich einige ihrer Gene noch heute im modernen Menschen finden, all diese Fragen ließen sich aber auf Basis rein anatomischer Untersuchungen nicht beantworten. Svante Pääbo, Direktor am Max-Planck-Institut für evolutionäre Anthropologie in Leipzig, war überzeugt, dass die Neandertalerknochen noch einen größeren Schatz bereithalten.
2005 hatte ein wissenschaftliches Konsortium unter Beteiligung von Pääbos Arbeitsgruppe das Genom des Schimpansen sequenziert und nachgewiesen, dass sich nur etwas mehr als ein Prozent der Nucleotide in den DNA-Sequenzen, die der moderne Mensch mit dem Schimpansen gemeinsam hat, unterscheiden. „Die Neandertaler sollten uns natürlich noch viel näher stehen“, sagt Pääbo. „Wenn wir aus ihren Knochen die DNA extrahieren und dann analysieren könnten“, so die Überlegungen des Molekularbiologen, „dann würden wir zweifellos feststellen, dass die Neandertaler-Gene den unseren sehr ähnlich sind.“ Viel spannender aber wären die Unterschiede: „Unter den winzigen Abweichungen, die wir erwarteten, sollten auch genau jene sein, die uns von allen unseren menschlichen Vorläufern unterscheiden und die die biologische Basis dafür gewesen sind, dass der moderne Mensch eine vollkommen neue Entwicklungsrichtung eingeschlagen hat – kulturell und technologisch.“
Die Untersuchung alter DNA erweist sich jedoch gleich in zweierlei Hinsicht als schwierig: Der eigentliche Anteil alter DNA in einem Knochenfragment kann zwischen 100 bis weniger als 0.1 Prozent liegen. In vielen Fällen sind die Proben mit der DNA von Bakterien verunreinigt. Eine weitere Quelle für Verunreinigungen ist die DNA heutiger Menschen. Denn sie ist allgegenwärtig – wir hinterlassen unsere DNA mit kleinsten Hautschuppen etc. und kontaminieren so auch archäologische Funde. Bei der Untersuchung frühmenschlichen Erbguts ist diese Kontamination aufgrund der Ähnlichkeit der DNA-Sequenzen nur schwer zu entdecken.
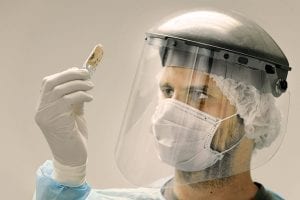
Abb. A: Um Verunreinigungen der Knochen mit eigener DNA zu verhindern, müssen die Forschenden umfangreiche Vorsichtsmaßnahmen treffen.
© Frank Vinken / MPG
Um die Authentizität alter DNA-Sequenzen sicherzustellen, versuchen Forschende, Verunreinigungen an der Ausgrabungsstätte sowie bei ihren weiteren molekularbiologischen Untersuchungen zu verhindern (Abb. A) oder – wenn das nicht bzw. nicht mehr möglich ist – die Verunreinigung bei der Analyse der Sequenzdaten zu identifizieren. Dabei machen sie sich den Umstand zu Nutze, dass post mortem, also nach Eintreten des Todes, Buchstaben in der DNA ausgetauscht werden: So wird Cytosin durch Thymin ersetzt bzw. Guanin durch Adenin, wenn es sich um das Gegenstück des DNA-Stranges handelt. Außerdem steigt an beiden Enden des DNA-Moleküls der Anteil jener Cytosine, denen eine Aminogruppe abhandengekommen ist. Das Cytosin wird damit zu einem Uracil, einem Nukleotid, das normalerweise in der RNA vorkommt. Die DNA-Polymerase behandelt dieses „U“ wie ein „T“ – überproportional viele Ts in bestimmten Regionen sind daher ein ausgesprochen zuverlässiges Signal, um alte von neuer DNA zu unterscheiden.
Eine weitere Erschwernis liegt darin, dass alte DNA den chemischen Abbauprozessen schon länger ausgesetzt ist, was zu einer starken Fragmentierung führt. In den Knochenproben nimmt der Anteil von DNA-Sequenzen mit kürzeren Fragmentlängen daher zu. Mit der bestehenden Technologie zur DNA-Sequenzierung konnten diese kurzen Fragmente jedoch nicht schnell und in großer Zahl ausgelesen werden.
Den Durchbruch brachte eine ganz neue Technologie der DNA-Sequenzierung. Das Grundprinzip des Sequenzierens ist dabei unverändert geblieben: Entlang eines abzulesenden DNA-Stückes wird eine komplementäre Sequenz hergestellt. Der Einbau erkennbarer (in den meisten Fällen mit Farbstoffen markierter) Nukleotide wird registriert und anhand der zeitlichen Abfolge der Einbauereignisse die gesuchte Sequenz ermittelt. Dieses Prinzip liegt auch der Next Generation Sequencing Technology (NGS) zugrunde – nur dass hierbei das Grundprinzip des Sequenzierens in unglaublich verdichteter, effizienter und extrem vervielfältigter Weise zur Anwendung gebracht wird. Im Rahmen von Next Generation Sequencing können so mehrere Tausend bis Millionen Sequenzierungsschritte gleichzeitig und hochgradig automatisiert ablaufen (Abb. C). Das ermöglicht einen enorm hohen Probendurchsatz, so dass ein komplettes menschliches Genom mit seinen 3,2 Milliarden Buchstaben, für das das Human Genome Project noch 10 Jahre und hunderte Labore weltweit brauchte, inzwischen innerhalb weniger Tage von einem einzigen Labor sequenziert werden kann!
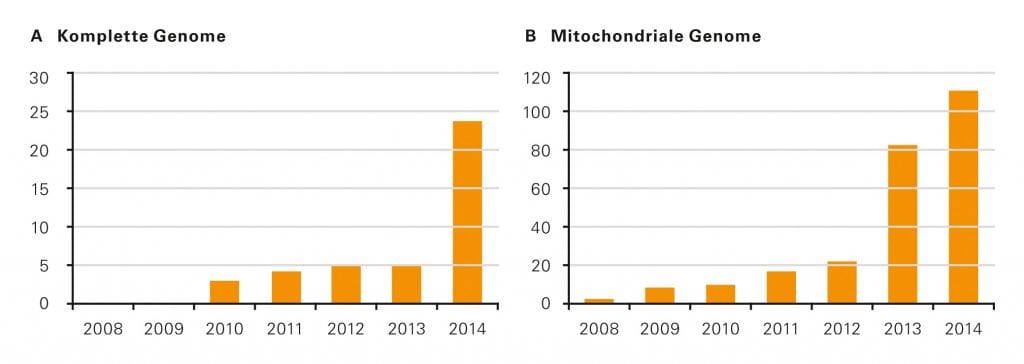
Abb. B: Gesamtzahl der publizierten vollständigen frühgeschichtlichen Humangenome.
© Investig Genet 6, 4 (2015). https://doi.org/10.1186/s13323-015-0020-4
Mittels NGS kann nun auch sehr alte, stark fragmentierte DNA mit Fragmenten, die kürzer als 60 oder 70 Basenpaare sind, sehr effektiv sequenziert werden. In Folge dessen setzte förmlich ein Boom bei der Sequenzierung alter DNA ein (Abb. B). Anfang 2006 präsentierten Stephan Schuster von der Pennsylvania State University und seine kanadischen Kollegen das 13 Millionen Basenpaare umfassende Kerngenom eines ausgestorbenen Wollmammuts. „Wir waren ein wenig enttäuscht, dass wir nicht als Erste die Sequenz einer alten DNA mit der neuen Sequenzierungstechnik aufgeklärt hatten“, berichtet Pääbo. Schließlich besaß seine Arbeitsgruppe schon seit Monaten die Daten aus den von ihr untersuchten Mammut- und Höhlenbärknochen. „Wir hatten aber weitere Analysen und Experimente durchgeführt, um ein möglichst vollständiges Bild zu veröffentlichen – die anderen hingegen wollten einfach nur schneller sein.“ Die Leipziger Forscherinnen und Forscher publizierten ihre Ergebnisse im September 2006 – und begannen noch im selben Jahr mit ihrem wohl riskantesten Projekt: der Sequenzierung des Neandertaler-Genoms. „Ich wusste, dass ein Erfolg nicht so einfach zu erzielen war“, erzählt Pääbo rückblickend. „Er hing vielmehr von drei Voraussetzungen ab: von vielen Sequenzierautomaten, viel mehr Geld und geeigneten Neandertalerknochen. Nichts davon hatten wir zu Beginn.“
Vier Jahre später war das scheinbar Unmögliche wahr geworden: Pääbo und sein Team konnten im Fachmagazin Science einen ersten Entwurf der Gensequenz unseres vor rund 30.000 Jahren ausgestorbenen Verwandten präsentieren. Der Entwurf basierte auf der Analyse von mehr als einer Milliarde DNA-Fragmenten aus mehreren Neandertaler-Knochen aus Kroatien, Spanien, Russland und Deutschland. Außerdem sequenzierten die Forschenden fünf menschliche Genome europäischer, asiatischer und afrikanischer Abstammung und verglichen diese mit dem Neandertaler-Genom. Der Vergleich förderte Erstaunliches zutage: In den Genomen aller außerhalb Afrikas lebender Menschen fanden sich Spuren vom Neandertaler. „Zwischen 1,5 und 2,1 Prozent der DNA im Genom der heutigen Nicht-Afrikaner stammen vom Neandertaler“, sagt Pääbo. „Asiaten tragen sogar noch etwas mehr davon in sich.“ Das waren klare Indizien für vielfachen artfremden Sex während der Eroberung Eurasiens.
Begonnen hatte das Techtelmechtel zwischen Neandertaler und Homo sapiens vor rund 50.000 bis 80.000 Jahren, als unsere Vorfahren den afrikanischen Kontinent verließen und sich in Europa und Asien ausbreiteten, wo sie auf die Neandertaler stießen. Während dieser Zeit kam es immer wieder zur erfolgreichen Fortpflanzung zwischen den eng verwandten Arten. Fügt man alle heute noch vorhandenen Schnipsel zusammen, lassen sich 40 Prozent des einstigen Erbmaterials der Neandertaler rekonstruieren. Von dieser DNA profitierten unsere Vorfahren. Während die meisten schädlichen Neandertaler-Gene durch Selektion aussortiert wurden, setzten sich nützliche in der menschlichen Population fest. Darunter auch solche, die mit der Beschaffenheit von Haut und Haaren in Verbindung stehen. Gut möglich also, dass unsere Vorfahren ihre weiße Haut von den Neandertalern erbten. Gerade in höheren Breiten war eine helle Körperoberfläche von Vorteil, weil damit die Produktion von Vitamin D aus Sonnenlicht effizienter ist. „Indem der moderne Mensch sich mit den Ureinwohnern seiner neuen Heimat mischte, konnte er sich besser an die neue Umgebung anpassen“, vermutet Pääbo.
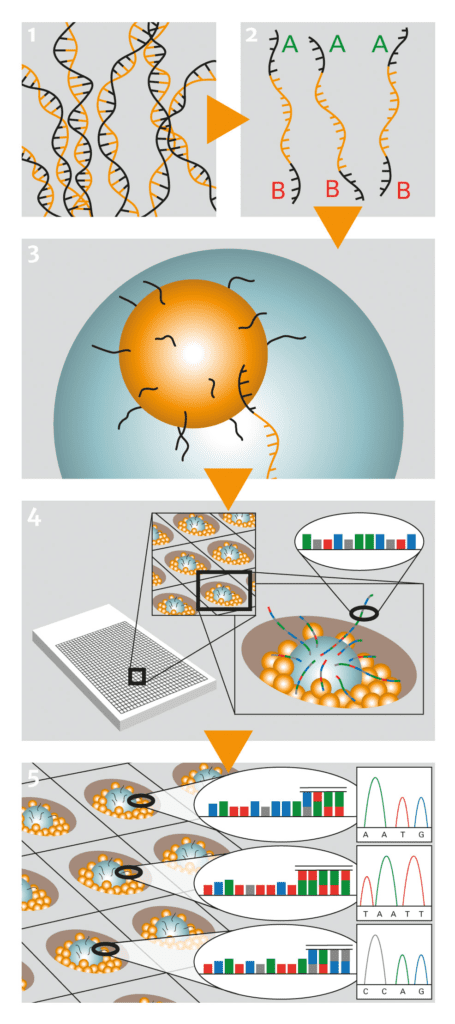
Abb. C: Next Generation Sequenzing. Svante Pääbo und sein Team sequenzierten mehr als 1 Million Basenpaare Neandertaler-DNA (1) unter Verwendung eines als Pyrosequenzierung bekannten Ansatzes. Bei diesem Verfahren wird die DNA zunächst in Einzelstränge überführt (2) und dann an mit Oligonukleotiden bestückte Mikroperlen (engl. beads) gebunden. Die DNA beladenen Mikroperlen werden zusammen mit den PCR-Reagenzien in Öl emulgiert, wobei idealerweise Emulsionströpfchen erzeugt werden, die nur eine Mikroperle enthalten (3). In dieser Umgebung werden die DNA-Stränge nun vervielfältigt (emPCR) und anschließend in die Vertiefungen einer Picotiterplatte gebracht, bei der unter jeder Pore ein Lichtleiter zu einem Detektor führt (4). Die DNA-Polymerase wird nun gewissermaßen „in Aktion“ beobachtet, wie sie nacheinander einzelne Nukleotide an den neu zu synthetisierenden DNA-Strang anhängt. Der erfolgreiche Einbau eines Nukleotids wird auf der Basis eines Fluoreszenzsignals von einem Detektor erfasst (5).
© Roche Diagnostics
Und welche Auswirkungen haben die geerbten Neandertalersequenzen heute? Anhand aktueller klinischer Daten lassen sich Einflüsse auf Funktionen der Haut, des Immunsystems und des Stoffwechsels erkennen. Einige Neandertaler-Gene, die wir in uns tragen, erhöhen das Risiko, an Diabetes Typ 2 oder Morbus Crohn zu erkranken. Im Kampf gegen Krankheitserreger kann der moderne Mensch allerdings von archaischen Gensequenzen auch profitieren: Sie kodieren für drei bestimmte Immunrezeptoren und verringern damit die Neigung zu Allergien.
Während der Neandertaler in bestimmten Regionen seines Genoms noch „Schimpansen-ähnliche“ Genvarianten besitzt, tragen die meisten modernen Menschen an derselben Stelle bereits abgeleitete Genvarianten. „Genau diese Bereiche unseres Genoms könnten entscheidend zur Entwicklung des modernen Menschen beigetragen haben, weil wir hier früh in unserer evolutionären Geschichte besonders vorteilhafte Mutationen erworben haben“, sagt Pääbo. Die Veränderungen im FOXP2-Gen, das mutmaßlich die Entwicklung unsere Sprechfähigkeit orchestriert, werden hingegen von Homo sapiens und Neandertaler geteilt. Möglich also, dass der Neandertaler in dieser Hinsicht über dieselben kognitiven Fähigkeiten verfügte. Insgesamt umfasst der Katalog der genetischen Unterschiede zwischen Frühmenschen und modernen Menschen 87 Proteine und eine Handvoll microRNAs (nichtcodierende RNA-Schnipsel, die eine wichtige Rolle bei der Genregulation spielen, insbesondere beim Stummschalten von Genen).
Und dabei stehen die Wissenschaftlerinnen und Wissenschaftler erst am Anfang, die funktionellen Folgen bestimmter genetischer Änderungen zu verstehen. So haben die Max-Planck-Teams zusammen mit Kollegen von den Universitäten Barcelona und Leipzig nicht nur die DNA-Sequenz einer frühmenschlichen Genvariante analysiert, sondern auch das entsprechende Protein hergestellt und seine Eigenschaften untersucht. Dabei fanden sie heraus, dass die Aktivität einer bestimmten Genvariante des Melanocortin-Rezeptors bei zwei Neandertalern deutlich reduziert war. Genvarianten mit einer ähnlich verringerten Aktivität sind auch beim modernen Menschen bekannt – mit sichtbaren Folgen: Ihr Träger hat eine rote Haarfarbe. Die Forschenden gehen daher davon aus, dass auch ein Teil der Neandertaler möglicherweise rote Haare besaß. Die Befunde der neuen Paläogenetik führen zu einer ganz neuen Sicht auf die evolutionären Prozesse, die einst den Homo sapiens hervorbrachten und ihm als letzten Vertreter seiner Gattung zum großen Auftritt auf unserem Planeten verholfen haben. Die Erkenntnisse zeigen: Die vielen Hunderttausend Jahre der Humanevolution verliefen anders, als man lange dachte. Seit es den Forschenden gelingt, die erhaltene Erbsubstanz in Knochenfunden zum Sprechen zu bringen, bröckelt die mühsam Knochen für Knochen aufgebaute Lehrmeinung. Homo sapiens steht nicht mehr als Krone der Evolution da, sondern eher als Spross diverser „Liebschaften“ in der Vorzeit.
Die Vorgänger leben weiter, im heutigen Menschen, in unserem Erbgut. Im Jahre 2010 sequenzierten Svante Pääbo und sein Team DNA aus dem winzigen Fragment eines Fingerknochens, den sie in der Denisova-Höhle in Südsibirien entdeckt hatten. „Mittels Genanalysen konnten wir zeigen, dass es sich um eine bis dahin unbekannte Menschenform handelt“, erklärt Pääbo.
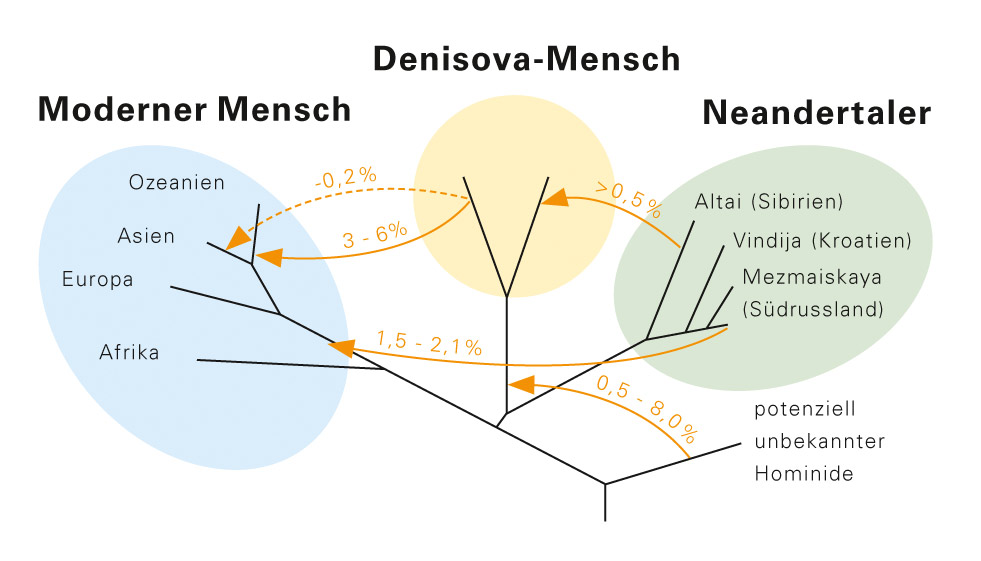
Abb. D: Die Abbildung zeigt die Richtung und den geschätzten Umfang der Genflüsse zwischen Neandertaler, Denisova-Mensch und modernem Menschen. Ob es einen direkten Genfluss vom Denisova-Menschen nach Asien gab, ist dabei ungewiss (gepunktete Linie). In drei von fünf Fällen konnten die Forscher eine Kreuzung zwischen vier verschiedenen Hominiden-Populationen nachweisen. Bei dem „potenziell unbekannten Frühmenschen“ könnte es sich um Homo erectus gehandelt haben.
© aus: K. Prüfer et al., Nature 505, 43–49, 2. Januar 2014
Und dass dieser Denisova-Mensch, wie die Forschenden ihn genannt haben, sich mit den Vorfahren der heutigen Bewohner von Australien, Neuguinea und Ostasien gepaart hat. Genomvergleiche belegen, dass es zwischen Neandertaler, Denisova und Homo sapiens zum Austausch von Genen (Genfluss) gekommen sein muss (Abb. D). „Vor diesem Hintergrund müssen wir den modernen Menschen inzwischen als Teil einer hominiden Metapopulation betrachten“, sagt Pääbo. „Einzigartig sind eigentlich nur die letzten 20.000 Jahre, in denen wir als Menschen allein auf der Welt waren.“ Und der Paläogenetiker prophezeit: „In Zukunft werden wir aus minimalen Funden sicher noch viel mehr über die Bevölkerungsgeschichte erfahren.“
Abbildungshinweise:
Titelbild: Svante Pääbo © Fank Vinken / MPG
Abb. A: Ohne Kontaminationen © Fank Vinken / MPG
Abb. B: Publizierte Humangenome © Investig Genet 6, 4 (2015). https://doi.org/10.1186/s13323-015-0020-4
Abb. C: Next Generation Sequenzing © Roche Diagnostics
Abb. D: Modell zum Genfluss © K. Prüfer et al., Nature 505, 43–49, 2. Januar 2014
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 33, Winter 2016/2017, durchgesehen 07/2022; Autorin: Christina Beck; Redaktion: Tanja Fendt
Diese Ausgabe wird nicht mehr aktualisiert und steht nur noch als pdf im Archiv zur Verfügung.
Solange der Vorrat reicht, können Restbestände der gedruckten Ausgaben über den Warenkorb bestellt werden.