Kohlenstoffdioxid aus der Luft mithilfe von Sonnenenergie nutzbar machen – diesen Prozess beherrschen Pflanzen bereits seit Jahrmillionen. Eröffnet die künstliche Fotosynthese einen Weg, um aus CO2 nachhaltig Rohstoffe zu produzieren? Mit einem synthetisch-biologischen Ansatz optimieren Wissenschaftlerinnen und Wissenschaftler schrittweise die Fotosynthese und entwickeln dabei auch ganz neue Stoffwechselwege, die in der Natur nicht zu finden sind. Helena Schulz-Mirbach beantwortet in dem Video Fragen zu ihrer Forschung am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg.
Videodatei | 16 min, Januar 2026
© MPG / CC BY-NC-ND 4.0

Tobias Erb mit Modell der Rubisco.
Foto: Chris Kettner
Vortrag von Prof. Dr. Tobias Erb (Max-Planck-Institut für terrestrische Mikrobiologie) zum Thema „Natürliche Photosynthese und synthetische Biologie“, gehalten am 8.11.25 auf der Fachfortbildung Schule MIT Wissenschaft in Marburg.
Videodatei | 40 min, November 2025
© MIT Club of Germany e. V.
Diese Aufnahme stellt die MIT Club of Germany gGmbH mit freundlicher Genehmigung für max-wissen.de zur Verfügung.
„Ich bin total im Stress!“ – wer hat das nicht schon oft gehört. Lernstress vor Prüfungen, Termindruck im Job, Social Media – manchmal wird es einfach zu viel. Aber was passiert da eigentlich in unserem Körper? Warum fühlen sich manche Menschen gestresster als andere? Und: Wie bleibt man mental gesund? Mathias V. Schmidt vom Max-Planck-Institut für Psychiatrie spricht mit Wissenschaftsjournalistin Alice Lanzke über Erkenntnisse aus der Stressforschung.
Audiodatei | 20 min, August 2025
© MPG / CC BY-NC-ND 4.0
Einem Forschungsteam am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften ist es erstmals gelungen, den gesamten Prozess des Eisprungs in Follikeln einer Maus zu filmen. Was bedeutet das für die Fruchtbarkeitsforschung?
Themen im Podcast
Grundlagen Menstruationszyklus (min 0:56)
Was passiert beim Eisprung? (min 2:28)
Wie entstand der Film zum Eisprung in Folliken der Maus? (min 2:58)
Neue Erkenntnisse zum Eisprung (min 6:37)
Übertragung auf den Menschen (min 8:37)
Bedeutung der Erkenntnisse, weiterführende Forschungsfragen (min 10:00)
Zum Podcast (13 min) vom 8. Mai 2025 © detektor.fm / Max-Planck-Gesellschaft
Hintergrundinfos und Video (Eisprung)
Foto: © Christopher Thomas, Tabea Lilian Marx et al./ MPI für Multidisziplinäre Naturwissenschaften
„Ich bin total im Stress!“ – wer hat das nicht schon oft gehört. Ob in Schule, Studium oder Beruf: Lernstress vor Prüfungen, Termindruck im Job und manchmal sogar Freizeitstress, wenn man sich unter der Woche zu viel vorgenommen hat. Stress hat in unserer Gesellschaft ein ausgesprochen schlechtes Image. Zu Recht? „Ohne Stress wäre unser Leben ziemlich langweilig“, sagt der Biologe Mathias V. Schmidt vom Max-Planck-Institut für Psychiatrie in München. „Wir könnten unseren Alltag gar nicht bewältigen, wenn es keinen Stress gäbe und wir kein funktionierendes Stresssystem hätten.“
Stress ist also per se nichts Negatives. Das Stresshormon Cortisol etwa hilft uns dabei, morgens überhaupt aufstehen zu können – zu diesem Zeitpunkt ist die Cortisol-Konzentration im Blut erhöht. Sie sorgt dafür, dass wir mit Energie in den Tag starten. Abends sinkt sie wieder, damit wir zur Ruhe kommen. „Im Grunde helfen uns Stressreaktionen dabei, die ganz normalen Herausforderungen des Alltags zu bewältigen. Stress gehört zum Leben dazu“, sagt Mathias V. Schmidt. Problematisch wird es, wenn wir zu viel Stress haben – und zwar in Bezug auf Intensität und Dauer (Abb. A). Hält Stress zu lange an, kann unser Stoffwechsel nicht mehr in den Normalzustand zurückkehren. Ein solcher Dauerstress kann krank machen und psychische Erkrankungen wie zum Beispiel Depressionen auslösen. Auch besonders intensiver Stress, etwa durch traumatische Erlebnisse, kann zu solchen Erkrankungen führen. Mathias V. Schmidt untersucht unter anderem an Mäusen, wie verschiedene Arten von Stress auf Säugetiere wirken. Mäuse sind dafür gut geeignet, weil ihr Stresshormon-System und die Rezeptoren – die Andockstellen für Stresshormone in ihrem Gehirn – denen des Menschen sehr ähnlich sind. In seiner Forschung hat der Biologe unter anderem herausgefunden, dass sozialer Stress bei Mäusen einer der stärksten Stressoren überhaupt ist.

Abb. A: Ursachen von Stress. Auszug einer Befragung von volljährigen Personen in Deutschland im Frühjahr 2021: Große Stressfaktoren sind – wie schon vor der Corona-Pandemie – das Pensum an Anforderungen von Schule, Studium und Beruf sowie hohe Ansprüche an sich selbst. Stark an Bedeutung gewonnen hat durch die Pandemie die Sorge um erkrankte Nahestehende. Weitere Ursachen siehe Quelle.
© Quelle Zahlen: Techniker Krankenkasse (TK-Stressstudie, 2021); Grafik: HNBM
Sozialer Stress macht Mäuse vor allem dann krank, wenn er sich nicht kontrollieren lässt und unerwartet auftritt. Experimente lassen sich zum Beispiel so konstruieren, dass eine Maus bei Auseinandersetzungen immer verliert. Experten sprechen von „social defeat“ – „sozialer Niederlage“. Eine solche Maus entwickelt zwar keine Depression, zeigt aber krankhafte Veränderungen. So kann sie zum Beispiel apathisch oder fettleibig werden. Diese Ergebnisse seien auf den Menschen übertragbar, betont Schmidt: „Auch beim Menschen wirkt vor allem jener Stress besonders stark, der unkontrollierbar und unberechenbar ist, zum Beispiel bei Mobbing, das Menschen auf Dauer krank machen kann.“ Ein anderes Beispiel sei die Corona-Pandemie gewesen. Zu Beginn der Pandemie im Frühjahr 2020 war noch unklar, wie gefährlich der Erreger ist und wie man sich wirkungsvoll dagegen schützen kann. Die Menschen fühlten sich ständig einer unberechenbaren Gefahr ausgesetzt. „Durch diesen chronischen Stress hat die Zahl depressiver Symptome damals messbar zugenommen“, erklärt der Max-Planck-Forscher (Abb. B). Als dann die ersten Impfstoffe auf den Markt kamen und klar wurde, wie man sich schützen kann, nahm der Stress wieder ab. „Kontrollierbaren Stress können wir Menschen deutlich besser bewältigen.“ Prüfungsstress kann man beispielsweise minimieren, indem man frühzeitig beginnt, den Lernstoff in kleine Einheiten aufteilt und einen Zeitplan erstellt. Durch Simulieren der Prüfungssituation gewinnt man an Sicherheit. Zu bedenken ist aber auch, dass jeder Mensch anders auf Stressoren reagiert“, so der Wissenschaftler.
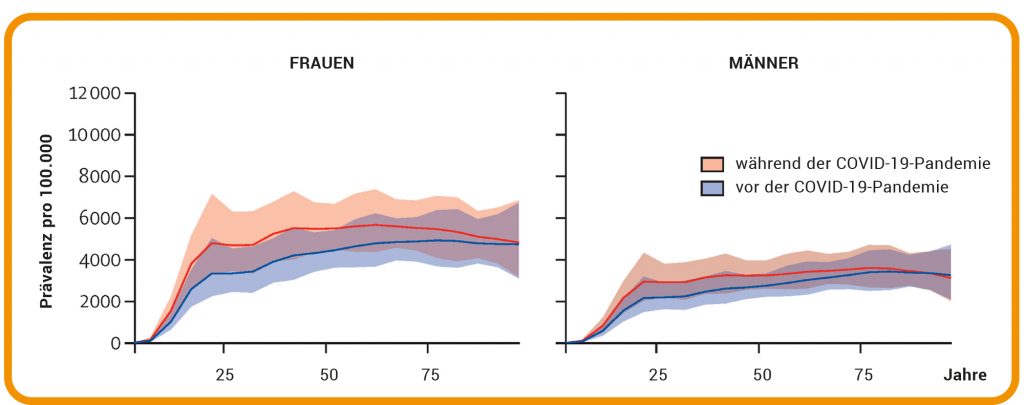
Abb. B: Mögliche Folgen von unkontrollierbarem Stress. Globale Prävalenz von schweren depressiven Störungen vor und während der COVID-19-Pandemie nach Alter und Geschlecht.
© Quelle: Lancet 2021; 398: 1700–12, Fig. 1 (Auszug); https://doi.org/ 10.1016/S0140-6736(21)02143-7 / CC BY 4.0
Anhaltender, unkontrollierbarer Stress und traumatische „Stresserlebnisse“ können also zu einer Depression führen. Welche Mechanismen dahinterstecken und welche Veränderungen im Stoffwechsel Depressionen auslösen, hat man bisher aber nur zum Teil verstanden. Vor 50 Jahren gingen Fachleute noch davon aus, dass Depressionen einzelne, klare Auslöser hätten. Gemäß dieser Vorstellung habe die Erkrankung ihre Ursache in veränderten biochemischen „Pfaden“ (engl. pathways), also einzelnen, klar umrissenen Stoffwechselwegen. Inzwischen ist die Forschung deutlich weiter: Tatsächlich können Depressionen viele verschiedene biologische Auslöser haben. Etwa ein Drittel des Risikos, an einer Depression zu erkranken, ist auch genetisch bedingt – Genomanalysen von Menschen mit Depressionen haben gezeigt, dass viele Gene an der Entstehung einer Depression beteiligt sind. Dieses genetische Risiko spielt mit den Risiken durch Stress zusammen, und könnte zum Teil erklären, warum Menschen resilient oder weniger resilient gegenüber Stresserfahrungen sind.
Ein Forschungsteam am Max-Planck-Institut für Psychiatrie ist genau dieser Frage nachgegangen, welche genetischen Varianten an der Reaktion auf Stress und dem Risiko, eine psychiatrische Störung zu entwickeln, beteiligt sein könnten. Dazu nutzten sie eine Substanz namens Dexamethason, die ähnlich wirkt wie das Stresshormon Cortisol und ebenso wie dieses eine molekulare und zelluläre Antwort, beginnend auf der Ebene der DNA, auslöst. Das Team untersuchte Zellen, die besonders empfindlich auf Stress reagieren. Dabei fanden sie über 500 Stellen im Erbgut (sog. Loci), die Reaktionen auf Stress zeigten, sowie 79 genetische Varianten, die die Expression von Genen und somit die molekulare Antwort auf Stress nur bei Behandlung mit Dexamethason beeinflussten. Diese Varianten stehen, wie große internationale Studien gezeigt haben, auch im Zusammenhang mit dem Risiko, eine psychiatrische Störung zu entwickeln.
Um herauszufinden, wie die Kombination der Varianten dieses Risiko beeinflusst, unterzog das Forschungsteam die Teilnehmenden der Studie einer Stressaufgabe. Dabei zeigte sich, dass eine höhere Anzahl dieser „stressreaktiven“ Genvarianten mit einem Anstieg des Cortisolspiegels bei den entsprechenden Probanden verbunden war. Dieser Unterschied wurde vor der Stressaufgabe nicht beobachtet, was heißt, dass diese Varianten nur in Stresssituationen von Bedeutung waren. Personen mit vielen dieser Genvarianten konnten ihr Stresshormon-System nach der Aufgabe nicht wieder schnell normalisieren und waren dadurch „unnötig“ lange gestresst. So zeigte ein weiterer Test, dass Personen mit mehr Risikovarianten bei Erschrecken intensiver reagierten und sich die Stärke der Schreckreaktion auch nach Wiederholen des Schreckreizes noch erhöhte. „Dabei hätte man eigentlich ein verringerte Reaktionen durch Gewöhnung erwartet“, erklärt Elisabeth Binder, Direktorin am Max-Planck-Institut für Psychiatrie.
„Die Genetik hat also einen Einfluss auf die Empfindlichkeit unserer Reaktion auf Stress. Der molekulare Mechanismus könnte erklären, warum belastende Lebensereignisse mal mehr oder weniger mit psychiatrischen Störungen korrelieren“, fasst Binder die Ergebnisse zusammen. Diese Erkenntnisse seien wichtig für die Vorhersage, welche Menschen ein höheres Risiko haben, als Reaktion auf Stress psychiatrische Störungen zu entwickeln, so die Forscherin weiter. Das könnte helfen, frühzeitig Hilfen anzubieten, um die Entwicklung von psychiatrischen Störungen zu vermeiden.
In zahlreichen Forschungsprojekten wird nach neuen Therapieansätzen für psychiatrische Störungen gesucht. Im Fokus der Untersuchungen steht dabei jenes Stresshormon-System, das unsere Anpassung an Stresssituationen koordiniert, die sogenannte Hypothalamus-Hypophysen-Nebennieren-Achse (HPA-Achse). Eine wichtige Schaltstelle in diesem System ist der Glukokortikoid- Rezeptor. Er kommt in nahezu allen Zellen vor und reguliert dort die Genexpression. Aber erst wenn das Stresshormon Cortisol an den Rezeptor bindet, kann dieser an die entsprechenden Kontrollstellen auf der DNA binden (Abb. C) und so die Transkription und damit die Biosynthese vieler verschiedener Proteine anstoßen, die für die Stressreaktion wichtig sind.
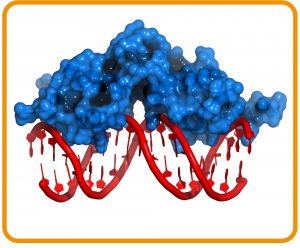
Abb. C: Schaltstelle für Stress. Glucocorticoid-Rezeptor (DNA-Bindungsdomäne), gebunden an einen DNA-Doppelstrang.
© molekuul.be / Adobe Stock
Die Empfindlichkeit des Glukokortikoid-Rezeptors gegenüber Cortisol wird durch eine Reihe von Molekülen, sogenannte Chaperone und Co-Chaperone moduliert. Chaperone beeinflussen die Aktivität anderer Proteine, indem sie diese bei der Faltung in ihre dreidimensionale Struktur unterstützen. Sie sind in verschiedenen Zelltypen und bei verschiedenen Proteinen aktiv. Das Chaperon mit dem Kürzel FKBP51 ist von besonderem Interesse, denn es setzt die Cortisol-Bindefähigkeit des Glukokortikoid-Rezeptors herab. Auf diese Weise sorgt es dafür, dass die Stressreaktion des Körpers wieder heruntergefahren wird, wenn der äußere Stress nachlässt, eine bedrohliche Situation beispielsweise vorüber ist. Das ist ein ganz natürlicher und wichtiger Mechanismus. Genomanalysen bei Menschen mit Stress-bedingten psychiatrischen Erkrankungen, wie der posttraumatischen Belastungsstörung (PTBS) und Depressionen, haben gezeigt, dass bei manchen von ihnen Veränderungen an genau jenem Gen vorliegen, das für das Chaperon FKBP51 kodiert. Möglicherweise wird FKBP51 deshalb vermehrt synthetisiert und dämpft den Glukokortikoid-Rezeptor dauerhaft. Das könnte, so die Annahme, bei depressiven Menschen zu Antriebslosigkeit und Niedergeschlagenheit führen. Auch Veränderungen der Interaktionen des Chaperons mit anderen für Nervenzellen wichtigen Proteinen könnten eine Erklärung dafür sein, warum manche Menschen mehr oder weniger stressresistent sind.
Chaperone sind ein hochinteressanter, potenzieller Angriffspunkt (engl. target) für neue Medikamente und damit verbunden die Therapie depressiver Menschen. Derzeit werden erste Chaperon-Antagonisten entwickelt, die die Aktivität der Chaperone oder deren Biosynthese hemmen. Die Herausforderung dabei: Es gibt viele verschiedene Chaperone, die in ganz verschiedenen Zellen und Geweben aktiv sind und die ganz unterschiedliche Stoffwechselreaktionen steuern. Das bedeutet, dass Chaperon-Antagonisten im Körper sehr gezielt in die für die Stressreaktion zuständigen Zellen eingeschleust werden müssten. Wie sich eine solche gezielte Form des „drug delivery“ technisch umsetzen ließe, ist noch Gegenstand der Forschung.
Aber es sind nicht immer die Gene, die dazu führen, dass manche Menschen nach einem traumatischen Erlebnis eine Depression entwickeln, während andere Menschen mit gleicher Erfahrung nicht erkranken. Tatsächlich spielen auch epigenetische Prozesse eine zentrale Rolle: Sie verändern beispielsweise das Muster der Methylgruppen an der DNA und damit die Aktivierbarkeit bestimmter Gene in bestimmten Zellen oder Organen (s. Biomax 23). So prägt die Epigenetik auch unser Stresssystem. Frühkindlicher Stress beispielsweise kann sich langfristig auf die psychische Gesundheit auswirken und das Risiko für die Entwicklung von Angststörungen und einer posttraumatischen Belastungsstörung erhöhen.
„Stress und Trauma in der Kindheit sind ein maßgeblicher Risikofaktor“, betont Elisabeth Binder. So gehen belastende Kindheitserfahrungen mit einem doppelt so hohen Risiko für depressive Störungen und einem 2,7-fach erhöhten Risiko für Angststörungen im Erwachsenenalter einher. Aber: „Ganz ohne Stress kann auch keine Resistenz aufgebaut werden“, betont die Medizinerin. Tatsächlich legt die Stressforschung der vergangenen Jahre nahe, dass Stressresistenz in der frühkindlichen Entwicklung erlernt wird. Durch seine Experimente an Mäusen hat Mathias V. Schmidt herausgefunden, dass es offenbar wichtig ist, in der Kindheit moderaten Stress zu erfahren. „Stresserfahrung ist essenziell, damit die Mäuse „lernen“, mit Stress umzugehen“, sagt Schmidt. Das sei höchstwahrscheinlich auch beim Menschen so. „Wer zum Beispiel überbehütet aufwächst, kann später den Stress, den Konflikte zwangsläufig mit sich bringen, schlechter bewältigen“, so der Forscher.
Dieses „Stress-Lernen“ findet sehr wahrscheinlich ebenfalls zu einem Teil auf der epigenetischen Ebene statt. „Wir gehen heute davon aus, dass das Erlernen von Stress in der frühkindlichen Entwicklung durch die Methylierung gesteuert wird“, sagt der Max-Planck-Forscher. Epigenetische Veränderungen fänden auch an den Histonen statt, jenen Proteinen, um die der DNA-Strang im Zellkern gewickelt ist. Durch Acetylierung der Histone kann die Wicklung verfestigt oder gelockert werden. Auch das beeinflusst, ob bestimmte Gene aktiviert oder unterdrückt werden. Mittlerweile gibt es konkrete Hinweise darauf, dass zahlreiche epigenetische Veränderungen einen Einfluss darauf haben, wie verschiedene Menschen auf Stress reagieren.
Um die Entwicklung psychiatrischer Erkrankungen zu verstehen, müssen somit neben den genetischen Analysen auch die epigenetischen Kodierungen identifiziert werden. Damit tun sich viele neue Wege für Therapien auf. Stress und Depressionen mögen ein komplexes Phänomen sein, doch die jüngsten Erkenntnisse liefern auch viele Ansatzpunkte für neue Medikamente. Schmidt: „Diese Entwicklungen stimmen mich zuversichtlich, dass wir in den nächsten Jahren große Fortschritte beim Verständnis des Stresses und bei der Entwicklung neuer Wirkstoffe gegen Depressionen und andere psychische Erkrankungen machen werden.“
Schau mir in die Augen – Pupillometrie als Diagnoseergänzung
Antriebslosigkeit ist eines der meist beobachteten Symptome der Depression. Ein Forscherteam des Max-Planck-Instituts für Psychiatrie hat herausgefunden, dass die geringere Pupillenreaktion bei Patienten und Patientinnen einen entsprechenden Hinweis darauf liefert. Bei gesunden Menschen erweitern sich die Pupillen bei der Erwartung auf eine Belohnung, wohingegen diese Reaktion bei Personen mit Depressionen weniger aus geprägt ist. Die Pupillenreaktion ist unter anderem ein Marker für die Aktivität im Locus Coeruleus, einer Gehirnstruktur mit der größten Ansammlung noradrenerger Neuronen im zentralen Nervensystem. Sie könnte als ergänzende Methode zur Diagnosestellung eingesetzt werden. Wenn beispielsweise ein Patient starke Beeinträchtigungen in der Pupillenreaktion zeigt, könnten Antidepressiva, die auf das noradrenerge System wirken, effektiver als andere Medikamente sein.
Abbildungshinweise:
Titelbild: © HNBM
Abb. A: © Quelle Zahlen: Techniker Krankenkasse (TK-Stressstudie, 2021); Grafik: HNBM
Abb. B: © Quelle: Lancet 2021; 398: 1700–12, Fig. 1 (Auszug); https://doi.org/ 10.1016/S0140-6736(21)02143-7 / CC BY 4.0
Abb. C: © molekuul.be / Adobe Stock
Abb. im Kasten: © MPI für Psychiatrie
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 40, April 2025; Text: Christina Beck, Tim Schröder; Redaktion: Tanja Fendt
Jahrzehntelang galt das Genom als unveränderlicher Bauplan, der bereits bei der Geburt festgelegt ist. Gene waren Schicksal: Sie sollten Aussehen, Persönlichkeit und Krankheitsrisiken bestimmen. Heute wissen wir, dass unsere Gene in Wechselwirkung mit verschiedenen Faktoren stehen – Prozesse, welche die Epigenetik erklärt. Alexander Meissner vom Max-Planck-Institut für molekulare Genetik erklärt Wissenschaftsjournalistin Alice Lanzke, was sich genau dahinter verbirgt, welche Prozesse dafür sorgen, dass Gene an- oder ausgeschaltet werden und welchen Einfluss Umweltfaktoren dabei spielen.
Audiodatei | 20 min, August 2024
© MPG / CC BY-NC-ND 4.0
Menschliche Eizellen bilden oft Spindeln mit mehreren Polen (blaue Kreise). Wird zusätzliches KIFC1 in die Eizelle eingebracht, verbessert es die Stabilität der bipolaren Spindel, indem es deren Mikrotubuli (blau) vernetzt. Die homologen Chromosomen (magenta) werden korrekt getrennt.
© Grafik: HNBM / CC BY-NC-SA 4.0
Reifeteilung I: Während der Reifeteilung I kann es zu einer fehlerhaften Trennung kommen, bei der die homologen Chromosomen falsch verteilt werden (Ia). Es kann auch ein einzelnes Chromatid falsch zugeordnet werden (Ib) oder beide Schwesterchromatiden verteilen sich umgekehrt (Ic). Durch diese inverse Verteilung besitzt die Eizelle zwar die richtige Chromosomenzahl, doch die Chromatiden stammen von verschiedenen homologen Chromosomen und sind nicht mehr durch Kohäsin verbunden, was die Ausrichtung und Trennung in der Reife teilung II beeinträchtigen kann.
Reifeteilung II: In der Reifeteilung II kann es zu einer fehlerhaften Trennung kommen, bei der beide Schwesterchromatiden entweder in der Zygote verbleiben (IIa) oder im zweiten Polkörper entsorgt werden (IIb).
© MPI für Multidisziplinäre Naturwissenschaften / Grafik: HNBM, CC BY-NC-SA 4.0
Verschiedene physiologische Faktoren können zur Unfruchtbarkeit beitragen und betreffen die Frau, den Mann oder beide Partner. Die prozentualen Anteile unterscheiden sich je nach Studie und untersuchten Kriterien. Die Angaben in der Abbildung stellen ungefähre Werte dar.
© Zahlen nach Forti, G. (1998), doi: 10.1210/jcem.83.12.5296 // Grafik: HNBM, CC BY-NC-SA 4.0
Laut einer 2023 veröffentlichten Studie der Weltgesundheitsorganisation ist jeder sechste Mensch im gebärfähigen Alter zumindest zeitweise unfruchtbar. Global sind 17,5 Prozent aller Männer und Frauen demnach an einem Punkt in ihrem Leben davon betroffen, kein Kind zeugen zu können. Ausgewählt und ausgewertet wurden dazu 133 aus weltweit mehr als 12.000 Studien, die zwischen 1990 und 2021 entstanden sind.
In Deutschland ist fast jedes zehnte Paar zwischen 25 und 59 Jahren ungewollt kinderlos. Die Gründe dafür sind vielfältig und – das ist wichtig zu wissen – betreffen beide Geschlechter. Tatsächlich sind die medizinischen Ursachen für Unfruchtbarkeit bei Männern und Frauen gleichverteilt (Abb. A). Die Hauptursache für ungewollte Kinderlosigkeit liegt hierzulande vor allem darin, dass die Menschen sich immer später für eine Elternschaft entscheiden. Das betrifft Männer wie Frauen gleichermaßen. Das Alter der Erstgebärenden ist in den vergangenen Jahrzehnten stetig gestiegen, ebenso wie das der Väter.
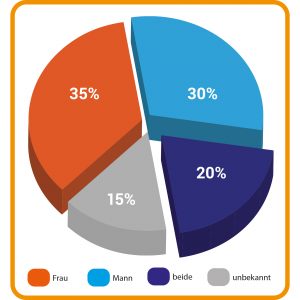
Abb. A: Verteilung der Unfruchtbarkeit: Verschiedene physiologische Faktoren können zur Unfruchtbarkeit beitragen und betreffen die Frau, den Mann oder beide Partner. Die prozentualen Anteile unterscheiden sich je nach Studie und untersuchten Kriterien. Die Angaben in der Abbildung stellen ungefähre Werte dar.
© Zahlen nach Forti, G. (1998), doi: 10.1210/jcem.83.12.5296 // Grafik: HNBM CC BY-NC-SA 4.0
So waren einer Studie des Max-Planck-Instituts für demografische Forschung in Rostock zufolge schon 2013 sechs Prozent aller Neuväter in Deutschland 45 Jahre oder älter und damit fast drei Mal so viele wie noch 1995. Es ist zwar richtig, dass Männer im Durchschnitt deutlich länger fruchtbar sind als Frauen. Etwa ab 40 bis 50 Jahren verschlechtert sich jedoch die Funktion der Spermien, weil sich genetische Defekte in den Samenzellen häufen. Wenn es insgesamt mehr Spermien mit Chromosomenstörungen gibt, dann dauert es länger, bis die Frau schwanger wird. Und abgesehen vom Alter gibt es weitere Faktoren, die die Zeugungsfähigkeit von Männern einschränken können – medizinische ebenso wie durch den Lebensstil implizierte wie Alkohol, Rauchen oder Übergewicht.
Bei Frauen enden die fruchtbaren Jahre deutlich früher. Im Alter zwischen 20 und 24 Jahren haben sie ihre höchste Fruchtbarkeit. Je älter Frauen werden, desto mehr sinkt jedoch die Wahrscheinlichkeit, schwanger zu werden, während die Wahrscheinlichkeit einer Unfruchtbarkeit ansteigt (Abb. B). Und das hängt ganz maßgeblich mit den Eizellen zusammen. So wird eine Frau bereits mit ihrer gesamten Reserve an Eizellen geboren. Im Laufe des Lebens entstehen keine neuen Eizellen mehr. Bei Geburt sind rund eine Million unreife Eizellen (Oozyten) angelegt. Die meisten sterben ab – zu Beginn der Pubertät sind noch etwa 300.000 übrig. Ihre Zahl nimmt dann weiter kontinuierlich ab. Bei einer von 100 Frauen ist die Eizellreserve bereits vor dem 40. Lebensjahr komplett erschöpft. Auch die Qualität der Eizellen sinkt ab dem 35. Lebensjahr deutlich. So steigt der Anteil jener Eizellen, die eine von der Norm abweichende Anzahl an Chromosomen aufweisen (man bezeichnet diese Eizellen als aneuploid). Bei Frauen ab 35 Jahren treten bei mehr als 50 Prozent der Eizellen Aneuploidien auf. Man spricht hier vom „maternal age effect“ (mütterlicher Alterseffekt).
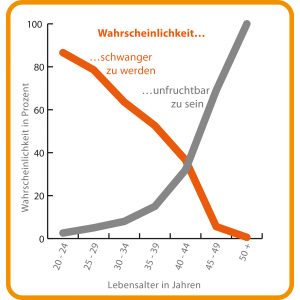
Abb. B: Die biologische Uhr tickt
© Quellen: Carcio, H. A.: Management of the Infertile Woman; Rosenthal, M. S.: The Fertility Sourcebook (1998) // Grafik: HNBM
Am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften in Göttingen erforscht das Team um Melina Schuh die Entwicklung von Eizellen – und was dabei alles schief gehen kann. Denn tatsächlich sind bereits bei jungen Frauen im Alter von 20 bis Anfang 30 mehr als 20 Prozent der Eizellen aneuploid. „Im Gegensatz dazu sind nur ein bis zwei Prozent der Spermien und weniger als ein Prozent der meisten somatischen Zelltypen aneuploid“, erklärt Schuh. Wenn diese fehlerhaften Eizellen befruchtet werden, dann führt das typischerweise zu Fehlgeburten oder auch zu Unfruchtbarkeit. Statistisch führt nur jede dritte Befruchtung bei Frauen zu einer erfolgreichen Schwangerschaft.
Eine reife Eizelle entwickelt sich aus einer Oozyte, die noch jeweils zwei Kopien von jedem Chromosom besitzt, also diploid ist. Um ein befruchtungsfähiges Ei zu werden, muss sie daher die Hälfte ihrer 46 Chromosomen ausschleusen. Dies geschieht einmal pro Menstruationszyklus in einer spezialisierten Zellteilung, der Reifeteilung I. Dabei werden die homologen Chromosomen der Oozyten mithilfe einer komplexen Maschinerie – dem Spindelapparat – getrennt. Er besteht aus Spindelfasern, die sich während der Meiose an die Chromosomen anheften. Die Fasern ziehen dann jeweils eines der homologen Chromosomen zu den gegenüberliegenden Polen der Spindel. Die Oozyte teilt sich dazwischen in eine große, nun haploide Eizelle und eine deutlich kleinere „Abfallzelle“, den sog. Polkörper.
„Genau das klappt jedoch oftmals nicht zuverlässig, sodass eine Eizelle mit falscher Chromosomenzahl entsteht“, erklärt Melina Schuh. Das Max-Planck-Forschungsteam will daher verstehen, wie die Zelle die Chromosomen vorbereitet, um sie in den Polkörper zu entsorgen, und wie die Maschinerie im Detail funktioniert, die die Chromosomen zwischen Eizelle und Polkörper verteilt. Die große Herausforderung dabei: Bei Säugetieren entwickeln sich die Oozyten im Inneren des Körpers. Um diesen Vorgang überhaupt untersuchen zu können, musste Schuh einen Weg finden, die Zellen außerhalb des Körpers zu kultivieren, und zwar so, dass sie diese über viele Stunden hinweg unter einem hochauflösenden Mikroskop untersuchen kann – eine Pionierleistung, die ihr schon während ihrer Promotion gelang.
„Was wir bereits wussten ist, dass menschliche Eizellen häufig Spindeln mit instabilen Polen bilden. Solche labilen Spindeln ordnen die Chromosomen bei der Zellteilung falsch an oder bringen sie durcheinander“, berichtet Schuh. Damit sind menschliche Oozyten im Tierreich eher eine Ausnahme. „Die Spindeln anderer Säugetier-Oozyten waren in unseren Experimenten sehr stabil“, so die Max-Planck-Direktorin. Um herauszufinden, was menschliche Spindeln derart labil macht, verglich das Team das molekulare Inventar an Proteinen, das für die Spindelstabilität erforderlich ist, in verschiedenen Säugetier-Oozyten. Für diese Versuche nutzten die Forschenden auch unbefruchtete unreife menschliche Eizellen, die nicht für die Kinderwunschbehandlung verwendet werden konnten und von den Patientinnen gespendet wurden. Ein Motorprotein (Motorproteine erzeugen Bewegungen innerhalb der Zelle) mit dem Namen KIFC1 weckte besondere Aufmerksamkeit: Es baut Brücken zwischen den Spindelfasern, hilft so, die Fasern richtig auszurichten, und verhindert, dass sie auseinanderfallen. Interessanterweise enthalten Oozyten von Mäusen und Rindern im Vergleich zu menschlichen Oozyten deutlich mehr von diesem Protein. Beeinflusst die Menge des Proteins somit möglicherweise die Stabilität der Spindeln?
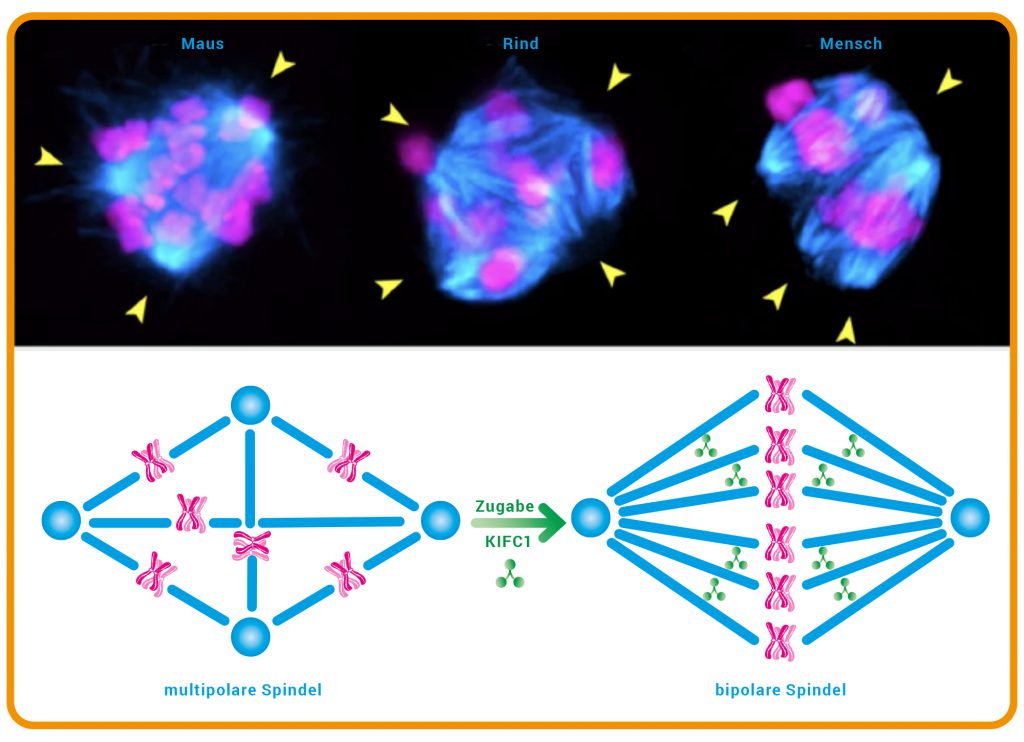
Abb. C: Instabile Spindeln.
Oben: Entfernt man den molekularen Motor KIFC1 aus Mäuse- und Rinder-Oozyten, entstehen multipolare Spindeln und Fehler bei der Chromosomentrennung, wie sie auch bei menschlichen Oozyten mit instabilen Spindeln beobachtbar sind. Die gelben Pfeile weisen auf die instabilen Spindelpole.
Unten: Menschliche Eizellen bilden oft Spindeln mit mehreren Polen (blaue Kreise). Wird zusätzliches KIFC1 in die Eizelle eingebracht, verbessert es die Stabilität der bipolaren Spindel, indem es deren Mikrotubuli (blau) vernetzt. Die homologen Chromosomen (magenta) werden korrekt getrennt.
© Foto: Chun So / MPI für Multidisziplinäre Naturwissenschaften; Grafik: HNBM / CC BY NC-SA 4.0
Um das herauszufinden, entfernten die Forschenden KIFC1 aus den Oozyten von Mäusen und Rindern. Das Ergebnis: Ohne das Protein bildeten auch Mäuse- und Rinder-Oozyten instabile Spindeln und es kam zu mehr Fehlern bei der Chromosomentrennung (Abb. C). „Unsere Versuche legen tatsächlich nahe, dass KIFC1 entscheidend dazu beiträgt, Chromosomen bei der Meiose fehlerfrei zu verteilen“, erklärt Schuh. Könnte das Protein daher ein Ansatzpunkt sein, um Fehler bei der Chromosomentrennung in menschlichen Eizellen zu reduzieren? „Für uns war die spannende Frage, ob die Spindel stabiler wird, wenn wir zusätzliches KIFC1 in menschliche Oozyten einbringen“, erklärt Schuh. Unter dem Mikroskop waren in den Zellen, die zusätzliche Mengen des Motorproteins enthielten, die Spindeln deutlich intakter und es traten weniger Fehler beim Trennen der Chromosomen auf. „Das Einbringen von KIFC1 in menschliche Oozyten ist somit ein möglicher Ansatz, um Fehler in Eizellen zu reduzieren“, hofft die Max-Planck-Forscherin.
Aber das ist nicht der einzige Entwicklungsschritt, der fehlerbehaftet ist (siehe Kasten). Das Göttinger Team hat sich insbesondere gefragt, warum das Risiko, aneuploide Eizellen zu erzeugen, für Frauen in fortgeschrittenem Alter deutlich höher ist und dabei das sogenannte Zygoten-Stadium in den Blick genommen, also die Phase direkt nach der Vereinigung von Spermium und Eizelle. Während nämlich in der Reifeteilung I die homologen Chromosomen auf Eizelle und Polkörper verteilt werden, werden in der Reifeteilung II nach der Befruchtung die Schwesterchromatiden eines jeden homologen Chromosoms voneinander getrennt und auf die Zygote und einen zweiten Polkörper verteilt.
Was alles bei der Verteilung schief gehen kann
Reifeteilung I: Während der Reifeteilung I kann es zu einer fehlerhaften Trennung kommen, bei der die homologen Chromosomen falsch verteilt werden (Ia). Es kann auch ein einzelnes Chromatid falsch zugeordnet werden (Ib) oder beide Schwesterchromatiden verteilen sich umgekehrt (Ic). Durch diese inverse Verteilung besitzt die Eizelle zwar die richtige Chromosomenzahl, doch die Chromatiden stammen von verschiedenen homologen Chromosomen und sind nicht mehr durch Kohäsin verbunden, was die Ausrichtung und Trennung in der Reife teilung II beeinträchtigen kann.
Reifeteilung II: In der Reifeteilung II kann es zu einer fehlerhaften Trennung kommen, bei der beide Schwesterchromatiden entweder in der Zygote verbleiben (IIa) oder im zweiten Polkörper entsorgt werden (IIb).
© MPI für Multidisziplinäre Naturwissenschaften / Grafik: HNBM / CC BY-NC-SA 4.0
Ringförmige Proteinstrukturen, sogenannte Kohäsin-Komplexe, halten die Schwesterchromatiden zusammen. Sie werden im weiblichen Embryo sehr früh während der DNA-Verdopplung installiert. Studien an Maus-Oozyten zeigen, dass Kohäsin-Komplexe später im Leben nicht mehr neu installiert werden können. „Wenn dies auch für menschliche Oozyten gilt, dann müssen Kohäsin-Komplexe die Chromosomen mehrere Jahrzehnte des Lebens zusammenhalten, bevor sie bei einem Ovulationszyklus zur korrekten Chromosomentrennung beitragen“, erklärt Schuh. Mit fortschreitendem Alter geht das Kohäsin jedoch verloren – zumindest bei der Maus –, was zu einer vorzeitigen Trennung der Schwesterchromatiden während der Reifeteilung I führt. „Wenn die Schwesterchromatiden bereits getrennt sind, dann werden sie zufällig und somit gegebenenfalls eben fehlerhaft zwischen den beiden Spindelpolen verteilt“, erklärt die Wissenschaftlerin. Ob Kohäsin auch in menschlichen Eizellen aus den Chromosomen verloren geht, ist noch nicht klar. Allerdings erfahren Chromosomen in menschlichen Oozyten während der Alterung ähnliche Strukturveränderungen wie die Forschenden sie in Oozyten älterer Mäuse beobachten.
Es besteht also weiterhin Forschungsbedarf und somit viel Arbeit für Melina Schuh und ihr Team in Göttingen. Für die Durchführung entsprechender Studien bedarf es immer wieder auch neuer Methoden, die in Schuhs Abteilung in den vergangenen Jahren entwickelt wurden, wie beispielsweise jene, mit der Proteine aus Eizellen funktional untersucht werden können. Ihr erklärtes Ziel dabei: „Wir möchten mehr Paaren helfen, ihren Kinderwunsch zu erfüllen und auch dazu beitragen, dass es mehr Geburten mit weniger In-vitro-Fertilisationszyklen gibt, dass also Kinderwunschbehandlung effizienter ablaufen kann“, so die Forscherin.
Abbildungshinweise:
Titelbild © Chun So / MPI für Multidisziplinäre Naturwissenschaften
Abb. A: © Zahlen nach Forti, G. (1998), doi: 10.1210/jcem.83.12.5296 // Grafik: HNBM / CC BY-NC-SA 4.0
Abb. B: © Quellen: Carcio, H. A.: Management of the Infertile Woman; Rosenthal, M. S.: The Fertility Sourcebook (1998) // Grafik: HNBM
Abb. C: © Foto: Chun So / MPI für Multidisziplinäre Naturwissenschaften; Grafik: HNBM / CC BY-NC-SA 4.0
Kasten: © MPI für Multidisziplinäre Naturwissenschaften / Grafik: HNBM / CC BY-NC-SA 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 39, Frühjahr 2024; Text: Dr. Christina Beck; Redaktion: Dr. Tanja Fendt
![]() Mit dieser Ausgabe erscheint das 100. Heft seit Entstehung der MAX-Reihe, die neben dem BIOMAX auch die TECH- und GEOMAX-Hefte umfasst. Seit dem Jahr 1998 ist es das Ziel der Hefte, aktuelle Forschungsergebnisse aus den Max-Planck-Instituten für Schülerinnen und Schüler aufzubereiten und so das Interesse an der Wissenschaft zu wecken.
Mit dieser Ausgabe erscheint das 100. Heft seit Entstehung der MAX-Reihe, die neben dem BIOMAX auch die TECH- und GEOMAX-Hefte umfasst. Seit dem Jahr 1998 ist es das Ziel der Hefte, aktuelle Forschungsergebnisse aus den Max-Planck-Instituten für Schülerinnen und Schüler aufzubereiten und so das Interesse an der Wissenschaft zu wecken.