Die Sammlung enthält Aufgaben zu folgenden Themen:
Haber-Bosch-Verfahren / chem. Gleichgewicht / Diagramm Katalysator-Trägermaterial / Eignung von Ammoniak als Wasserstoffspeicher / Film: „Grüner Stahl“
Unterrichtsmaterial zum Techmax 10
Es klingt nach Science-Fiction: Durch riesige Spiegel im All, die Verdunkelung der Sonne oder die Imitation eines Vulkanausbruchs sollen die Folgen der globalen Klimakrise wenn nicht gestoppt dann doch zumindest gemindert werden. Solche Eingriffe ins natürliche Klimasystem werden unter dem Begriff „Climate Engineering“ zusammengefasst. Wissenschaftsjournalistin Alice Lanzke spricht mit Forscherin Ulrike Niemeier vom Max-Planck-Institut für Meteorologie über das Ausbringen von Sulfat-Aerosolen in der Stratosphäre und lässt sich die Chancen und Risiken der Methode erklären.
Audiodatei | 16 min, November 2023
© MPG / CC BY-NC-ND 4.0
Das Trägermaterial besteht aus γ-Aluminiumoxid (links; Sauerstoff: kleine, dunkelrote Kugeln ; Aluminium: große, rosafarbene Kugeln). Auf der Oberfläche des Trägers bildet sich beim Herstellungsprozess elementares Cobalt. Dieses katalysiert die Ammoniakzerlegung. Ein Teil des Cobalts wandert in den Träger und bildet einen Mischkristall (rechts). Das Cobalt ist in dieser Form (blau: CoO4) nicht mehr katalytisch wirksam.
© C. Weidenthaler, MPI für Kohlenforschung / CC BY-NC-SA 4.0
Test von vier verschiedenen Proben des Katalysator-Trägermaterials, die entweder bei 550 oder 700 °C hergestellt wurden. Zwei Proben enthielten 4, zwei 8 Gewichtsprozent Cobalt. Untersucht wurde die Zerlegung von NH3 bei Temperaturen von 350 bis 650 °C. Das Katalysator-Trägermaterial, das bei 550 °C hergestellt wurde, ist effektiver, da bei niedrigeren Herstellungstemperaturen weniger Cobalt mit dem Al2O3 im Träger reagiert und als Katalysator inaktiviert wird. Ein höherer Anteil von Cobalt in der Probe wirkt sich positiv auf die NH3-Zerlegung aus, weil mehr Cobalt für die Katalyse zur Verfügung steht.
© C. Weidenthaler; verändert nach ChemCatChem, Volume: 14, Issue: 20, 2022, DOI: (10.1002/cctc.202200688) / CC BY 4.0
Die rot gestrichelte Energiekurve zeigt die Reaktion ohne, die durchgezogene grüne mit Katalysator: Die N2– und H2-Moleküle liegen frei vor (1). Das N2-Molekül haftet sich an die Eisenoberfläche (2). Die dort adsorbierten N2– und H2-Moleküle zerfallen zu N- und H-Atomen (3). Es entstehen NH (4), NH2 (5) und NH3 (6). Das fertige Ammoniakmolekül hat sich von der Eisenoberfläche gelöst (7). Die grün und rot gestrichelten Energiekurven enden rechts auf einem tieferen Energieniveau – bei der Reaktion wird Energie frei.
© Grafik: R. Wengenmayr nach G. Ertl / CC BY-NC-SA 4.0
Wasserstoff ist Hoffnungsträger einer klimaneutralen Wirtschaft – auch für die Stahlindustrie. Doch möglicherweise sollte die Branche zusätzlich auch auf Ammoniak setzen, um grünen Stahl zu erzeugen. Das legt die Studie eines Teams des Max-Planck-Instituts für Eisenforschung in Düsseldorf nahe. Darin zeigen die Forschenden, dass Ammoniak ebenso gut geeignet ist wie Wasserstoff, um Eisenerz in Eisen umzuwandeln. Ammoniak kann mit Wasserstoff produziert werden, der mit regenerativem Strom etwa in sonnenreichen Ländern gewonnen wird. Er lässt sich jedoch viel leichter transportieren.
YouTube-Link: https://youtu.be/a_yUKX8zQfI
[Dauer des Videos: 2 min]
Hintergrundinformationen zum grünen Stahl

© David Bonsen / MPI für Kohlenforschung
Katalysatoren spielen als Reaktionsbeschleuniger in Natur und Technik eine entscheidende Rolle. Lebensprozesse werden von Enzymen angekurbelt, der „Autokat“ reinigt Abgase und über neunzig Prozent aller von der Chemieindustrie eingesetzten Reaktionen benötigen einen Katalysator. Dazu zählt die Ammoniaksynthese, der die Menschheit den künstlichen Stickstoffdünger verdankt. Weil Ammoniak viel Wasserstoff enthält, ist es auch als Wasserstoffspeicher für eine zukünftige Energiewirtschaft interessant. Allerdings muss es dazu auch wieder effizient in Wasserstoff und Stickstoff zerlegt werden. Der Schlüssel dazu sind neue Feststoffkatalysatoren, an denen Claudia Weidenthaler mit ihrem Team am Max-Planck-Institut für Kohlenforschung in Mülheim forscht.
„Ein Katalysator ist jeder Stoff, der, ohne im Endprodukt einer chemischen Reaktion zu erscheinen, ihre Geschwindigkeit verändert.“ Diese heute noch gängige Definition prägte der deutsche Chemiker Wilhelm Ostwald. Er erhielt 1909 den Nobelpreis für Chemie, danach brachte die Katalyseforschung viele weitere Nobelpreisträger hervor (s. Techmax 30). Katalysatoren eröffnen einer chemischen Reaktion einen günstigen Pfad durch eine Energielandschaft, der sonst verschlossen wäre. Während einer Reaktion brechen zuerst chemische Bindungen in den Edukten auf, dann bilden sich neue Bindungen. Dabei entstehen die Moleküle der Produkte. Den Reaktionsweg verstellt jedoch oft ein mächtiger Energieberg. Um diesen zu bezwingen, brauchen die Moleküle Energie. Der Katalysator senkt nun diesen hemmenden Energieberg ab. Grundsätzlich gibt es zwei Arten von Katalyse: Bei der homogenen Katalyse befinden sich die reagierenden Stoffe und der Katalysator in der gleichen Phase, etwa in einer Lösung. In der heterogenen Katalyse sind beide in getrennten Phasen. Bei technischen Anwendungen fließen dabei oft Gase über festes Katalysatormaterial, zum Beispiel beim „Autokat“.
Einen besonderen Beitrag hat die heterogene Katalyse zur Welternährung geleistet, denn ohne sie gäbe es keine Ammoniaksynthese. Diese bindet den Stickstoff aus der Luft chemisch im Ammoniak, aus dem wiederum Stickstoffdünger produziert wird. 2020 wurden weltweit 183 Millionen Tonnen Ammoniak produziert, was zwei Prozent des globalen Energieverbrauchs der Menschheit erforderte. Da die Energie und der Wasserstoff hauptsächlich aus fossilen Quellen stammten, setzte das 450 Millionen Tonnen CO2 frei. Das entspricht etwa 1,4 Prozent der menschlichen CO2-Emissionen im Jahr 2020. Ohne Katalysator wären allerdings Energieverbrauch und Emissionen ungleich dramatischer: Allein die Produktion von einem Kilogramm Ammoniak würde dann rund 66 Millionen Joule an Energie verbrauchen, was ungefähr der Verbrennungswärme von 1,5 kg Rohöl entspricht.
Als sich Ende des 19. Jahrhunderts der Weltvorrat an natürlichem Salpeter, aus dem Stickstoffdünger produziert wurde, erschöpfte, drohte eine Hungerkatastrophe. Rettung versprach der riesige Stickstoffvorrat in der Luft, denn sie besteht zu 78 Prozent aus Stickstoffmolekülen. Allerdings verschließt die sehr stabile Dreifachbindung des Moleküls den Zugang zu den Stickstoffatomen. An der dreifach harten Nuss scheiterten alle Forschenden – bis Fritz Haber sie 1909 knackte. Er entdeckte, dass Osmium als Katalysator unter hohem Druck die Ammoniaksynthese aus Stickstoff ermöglicht. Leider ist Osmium extrem selten, doch der Chemiker Carl Bosch und sein Assistent Alwin Mittasch fanden Ersatz: Eisen in Form winziger Nanopartikel erwies sich ebenfalls als guter Katalysator. Allerdings benötigte die Reaktion einen Druck von mindestens 200 bar und Temperaturen zwischen 400 °C und 500 °C. Boschs Gruppe konstruierte dafür einen massiven Durchflussreaktor. Schon 1913 startete die industrielle Produktion nach dem Haber-Bosch-Verfahren, das bis heute im Einsatz ist (s. Geomax 11). Haber erhielt 1919 den Nobelpreis für Chemie, Bosch 1931. Die Reaktionsgleichung der kompletten Ammoniaksynthese lautet N2 + 3 H2 -> 2 NH3. Die Reaktion ist exotherm, in der Bilanz wird Wärmenergie frei: Pro Mol N2 sind es 92,2 Kilojoule, pro Mol NH3 die Hälfte, was auf ein Kilogramm Ammoniak rund 2,7 Megajoule ergibt. So viel Wärmeenergie setzt die Verbrennung von 92 Gramm Steinkohle frei. Der Eisenkatalysator im Haber-Bosch-Verfahren beschleunigt nun diese Reaktion. Aber was sich da genau auf seiner Oberfläche abspielt, konnte die Forschung lange nicht aufdecken. Man ging davon aus, dass die Anlagerung der N2-Moleküle an seiner Oberfläche die Geschwindigkeit der Reaktion bestimmt. Offen blieb aber, ob die N2-Moleküle auf der Fläche zuerst in einzelne Stickstoffatome zerfallen und dann mit dem Wasserstoff reagieren oder ob das komplette N2-Molekül reagiert.
Erst 1975 konnten Gerhard Ertl und sein Team zeigen, dass das N2-Molekül tatsächlich zuerst zerfällt. Der spätere Max-Planck-Direktor setzte die damals neuesten Methoden der Oberflächenforschung ein. Er untersuchte die katalytische Wirkung von perfekt glatten Eisenoberflächen im Ultrahochvakuum. Metalle wie Eisen besitzen eine kristalline Struktur, bei der die Eisenatome ein geordnetes dreidimensionales Gitter ausbilden. Ein perfekter Kristall heißt „Einkristall“. Schneidet man durch ihn hindurch, sind die Eisenatome auf diesen Flächen in einem regelmäßigen Muster angeordnet. Unter solchen Idealbedingungen sollten sich die einzelnen Schritte des Katalyseprozesses leichter entschlüsseln lassen, vermutete Ertl. Tiefer im Kristall ist jedes Atom auf allen Seiten von Nachbaratomen umgeben. An der Oberfläche dagegen liegen die Atome frei. Kommt dort ein H2-Molekül vorbei, dann können sie es deshalb an sich binden. Das passiert allerdings nur etwa einmal in einer Million Fällen. Durch diese Bindung an das Eisen geht der Energiegewinn durch die Dreifachbindung im N2-Molekül verloren. Die Stickstoffatome lösen sich aus dieser Bindung und werden frei. Dem H2-Molekül des gasförmigen Wasserstoffs ergeht es genauso, doch dessen Einfachbindung ist ohnehin recht locker. Die einzelnen Stickstoff- und Wasserstoffatome können nun untereinander chemische Bindungen eingehen (Abb. A). Ertls Gruppe schaffte es, den kompletten Ablauf der Ammoniaksynthese zu entschlüsseln und zu zeigen, wie man sie optimiert. Gerhard Ertl führte damit die exakten Methoden der Oberflächenforschung erstmals in die Katalyseforschung ein. Dafür bekam der frühere Direktor am Berliner Fritz- Haber- Institut der Max -Planck- Gesellschaft 2007 den Nobelpreis für Chemie.
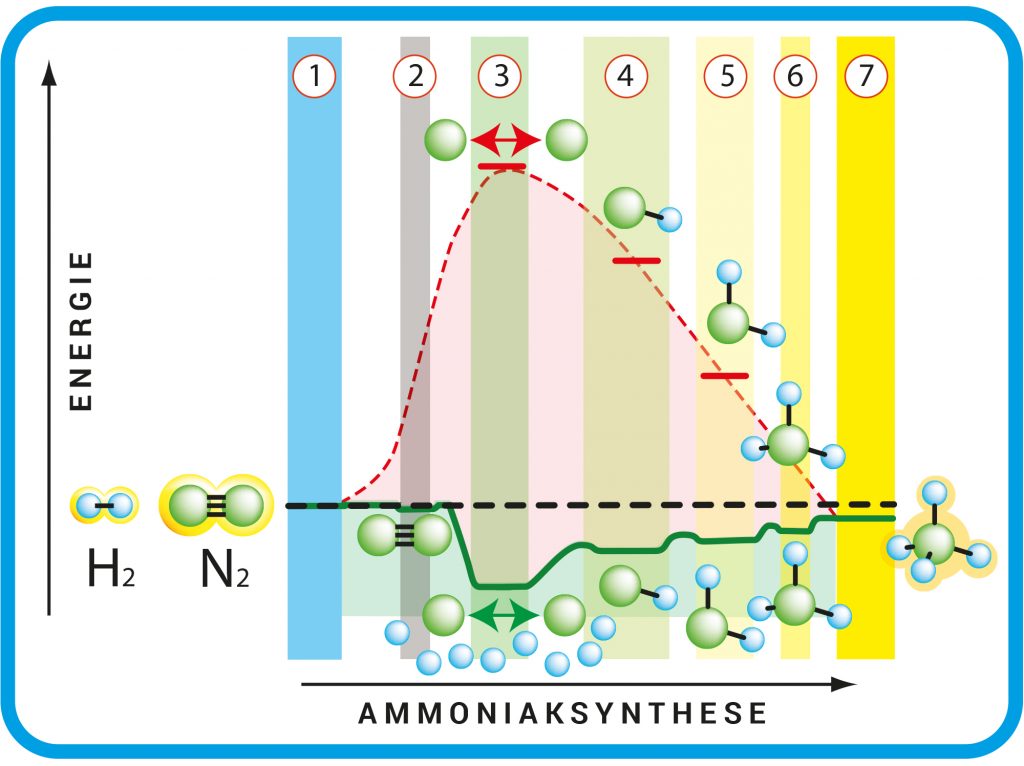
Abb. A: Schritte der Ammoniaksynthese. Die rot gestrichelte Energiekurve zeigt die Reaktion ohne, die durchgezogene grüne mit Katalysator: Die N2– und H2– Moleküle liegen frei vor (1). Das N2-Molekül haftet sich an die Eisenoberfläche (2). Die dort adsorbierten N2– und H2– Moleküle zerfallen zu N- und H- Atomen (3). Es entstehen NH (4), NH2 (5) und NH3 (6). Das fertige Ammoniakmolekül hat sich von der Eisenoberfläche gelöst (7). Die grün und rot gestrichelten Energiekurven enden rechts auf einem tieferen Energieniveau – bei der Reaktion wird Energie frei.
© Grafik: R. Wengenmayr nach G. Ertl / CC BY-NC-SA 4.0
Für eine Zukunft ohne fossile Brennstoffe gilt Wasserstoff als wichtiger Energieträger. Zum Beispiel könnten große Solarkraftwerke in sonnenreichen Ländern regenerativen Strom produzieren und in Elektrolyseanlagen Wasser zu Wasserstoff und Sauerstoff zerlegen. Der grüne Wasserstoff würde dann zum Beispiel in Tankschiffen nach Europa verfrachtet werden, wo er in Industrieprozessen oder für die Energieerzeugung, etwa in Brennstoffzellen (s. Techmax 16), verbraucht würde. Allerdings müsste der Wasserstoff dazu entweder gasförmig unter hohem Druck von 200 bar oder verflüssigt unterhalb von -252 °C in Tanks transportiert werden, was teuer und energetisch ineffizient ist. Im Vergleich dazu bietet Ammoniak als Wasserstoffspeicher einige Vorteile. Der erste Vorteil ist seine hohe Energiedichte von 3,2 Kilowattstunden pro Liter, pro Kilogramm sogar 5,2 Kilowattstunden – zum Vergleich: bei Benzin sind es 9,7 beziehungsweise 12,7 Kilowattstunden. Zweitens wird Ammoniak bei 20 °C schon bei 8,6 bar Druck flüssig, grob dem doppelten Druck eines Fahrradreifens. Damit ist es gut in Tanks transportierbar. Ammoniak könnte die Tankschiffe selbst emissionsfrei antreiben. Die „Viking Energy“ ist das erste Schiff mit einer Hochtemperatur-Brennstoffzelle, die aus Ammoniak elektrischen Strom für den Schiffsantrieb gewinnt. Allerdings kann Ammoniak nur ein effizienter Wasserstoffspeicher sein, wenn das chemische Binden und Rückgewinnen des Wasserstoffs möglichst wenig Energie verbraucht. Hier kommt die Forschung von Claudia Weidenthaler ins Spiel. Die Professorin erzählt, dass nach besseren Katalysatoren und alternativen industriellen Prozessen gesucht wird, die das traditionelle Haber-Bosch-Verfahren in der Effizienz schlagen können. Ihr Team sucht hingegen Metallkatalysatoren, die Ammoniak in einem „Cracker“-Reaktor möglichst effizient wieder zerlegen. Mit ihren Methoden steht sie in der Tradition des Pioniers Gerhard Ertl. Sie erforscht systematisch verschiedene Metalle, die sich theoretisch gut als Katalysatoren eignen. Und sie räumt auch gleich mit der Vorstellung auf, dass Katalysatoren sich während der Reaktion nicht verändern. Das Gegenteil ist der Fall. Umso wichtiger wäre es, die Vorgänge an ihrer Oberfläche und darunter, im Trägermaterial, bis auf die Ebene einzelner Atome direkt „filmen“ zu können.
Leider gibt es kein konventionelles Mikroskop, mit dem man einfach bis in die Welt der Atome zoomen und direkt im chemischen Reaktor Videos aufzeichnen kann. Also muss das Team verschiedene Methoden kombinieren, die eines gemeinsam haben: Sie verwenden Wellenlängen, die viel kürzer als die von sichtbarem Licht sind. Röntgenlicht und fliegende Elektronen in Elektronenmikroskopen sind kurzwellig genug, um auch Details bis teilweise hinunter in den Zehntelnanometerbereich erfassen zu können. Herkömmliche Elektronenmikroskope können sehr gut die Strukturen von Oberflächen abbilden, haben aber den Nachteil, dass sie Vakuum benötigen. Damit lassen sich also mit gewöhnlichen Geräten nur Bilder von Katalysatoroberflächen vor und nach der Reaktion aufnehmen. Für die Beobachtung der laufenden katalytischen Reaktion nutzt das Mülheimer Team daher verschiedene Röntgenmethoden. Mit Hilfe eines Röntgen-Pulverdiffraktometers (s. Titelbild) kann das Team das Innere der winzigen Kristalle durchleuchten. Die Methode ähnelt dem Physikexperiment, in dem Lichtwellen an einem feinen Gitter gebeugt werden (s. Techmax 15, Abb. A). Das dahinter aufgenommene Beugungsbild enthält die genaue Information über die Beschaffenheit des Gitters. Auch die Metallatome im Kristall bilden ein räumliches Gitter mit Abständen im Bereich von Zehntelnanometern. Passt die Wellenlänge des Röntgenlichts, so liefert das Beugungsbild eine genaue Information über den Aufbau des Kristalls – und dessen Veränderungen während der katalysierten Reaktion.
Die Reaktionsgleichung beim „Cracken“ von Ammoniak lautet 2 NH3 –> N2 + 3 H2. Diese Reaktion benötigt Energie, sie ist endotherm. Pro Mol NH3 sind das die schon bei der Synthese erwähnten 46,1 Kilojoule. Nun hat sich Eisen als relativ guter Katalysator beim Haber-Bosch-Verfahren etabliert. Doch ist es auch ein guter Katalysator für das Cracken? Eigentlich läge das nahe, ein Video kann ja auch einfach rückwärts ablaufen. Doch die Antwort lautet: nein. Für die Ammoniaksynthese und -zerlegung gilt, dass ein guter Katalysator für die eine Reaktionsrichtung nicht automatisch auch für die umgekehrte Richtung funktioniert. Der beste metallische Katalysator für das Zerlegen von NH3 ist nach heutigem Kenntnisstand Ruthenium. Da dieses Edelmetall aber selten und teuer ist, sucht Weidenthalers Team nach günstigeren Alternativen. Vor allem sollen sich die neuen Katalysatoren später auch für die Reaktoren in der Industrie eignen. Dabei ist das Zusammenspiel zwischen dem Katalysator und dem Trägermaterial, auf dem er aufgebracht ist, wichtig. Auch das untersucht das Team. Ein Beispiel ist die jüngste Arbeit mit Cobalt als Katalysator auf einem Träger aus Aluminiumoxid-Nanokristallen. Cobalt ist ein vielversprechender Kandidat für die Ammoniakzerlegung. Und Aluminiumoxid versprach ein gutes Trägermaterial: Bei hohen Temperaturen von mehreren hundert Grad verhindert es, dass die feinen Cobaltpartikel auf der Trägeroberfläche „zusammenbacken“. Sintern heißt dieser unerwünschte Effekt, der die gesamte Cobaltoberfläche verkleinern würde, die für die Katalyse noch zur Verfügung stünde.

Abb. B: Ammoniakzerlegung. Test von vier verschiedenen Proben des Katalysator-Trägermaterials, die entweder bei 550 oder 700 °C hergestellt wurden. Zwei Proben enthielten 4, zwei 8 Gewichtsprozent Cobalt. Untersucht wurde die Zerlegung von NH3 bei Temperaturen von 350 bis 650 °C. Das Katalysator-Trägermaterial, das bei 550 °C hergestellt wurde, ist effektiver, da bei niedrigeren Herstellungstemperaturen weniger Cobalt mit dem Al2O3 im Träger reagiert und als Katalysator inaktiviert wird. Ein höherer Anteil von Cobalt in der Probe wirkt sich positiv auf die NH3-Zerlegung aus, weil mehr Cobalt für die Katalyse zur Verfügung steht.
© C. Weidenthaler; verändert nach ChemCatChem, Volume: 14, Issue: 20, 2022, DOI: (10.1002/cctc.202200688) / CC BY 4.0
Das Mühlheimer Team stellte zunächst verschiedene Proben des Katalysator-Trägermaterials mit unterschiedlichen Cobaltanteilen bei Temperaturen von 550 °C und 700 °C her. Diese Proben testete das Team in einem Reaktor, durch den Ammoniakgas floss. Es konnte zeigen, dass sich eine niedrige Herstellungstemperatur und ein hoher Cobaltanteil positiv auf die Ammoniakzerlegung auswirken (Abb. B). Die getesteten Proben sind jedoch für die industrielle Anwendung noch nicht geeignet, da erst bei Temperaturen ab ca. 600 °C eine vollständige Zerlegung des Ammoniaks erreicht wird. Diese hohen Temperaturen benötigen für Industrieprozesse zu viel Energie. Bei niedrigeren Temperaturen wäre der entstehende Wasserstoff noch mit Ammoniak verunreinigt und würde beispielweise Probleme beim Einsatz in Brennstoffzellen verursachen. Die Forschenden untersuchten auch die Vorgänge bei der Herstellung des Katalysator-Trägermaterials: Auf der Oberfläche des Trägers bilden sich Nanopartikel von elementarem Cobalt, das katalytisch wirksam ist. Ein Teil des Cobalts wandert in das Trägermaterial, bildet mit dem Aluminiumoxid einen Mischkristall und wird dadurch inaktiviert (Abb. C). Für die industrielle Anwendung ist es auch wichtig zu untersuchen, was passiert, wenn der „Cracker“-Reaktor abgeschaltet wird und das Katalysator-Trägermaterial abkühlt. Dem Team gelang es nicht mehr, Cobalt auf der Oberfläche des Trägermaterials nachzuweisen. Claudia Weidenthaler erklärt: „Wir vermuten, dass die Cobalt-Nanopartikel beim Abkühlen in noch kleinere Partikel zerfallen und deshalb mit der Röntgendiffraktometrie nicht mehr nachweisbar sind. Deshalb setzen wir nun Röntgenspektroskopie-Methoden ein, die eine atomare Auflösung erlauben.“ Damit kommt Claudia Weidenthalers Team dem „Filmen“ von Katalysevorgängen schon sehr nahe.

Abb. C: Strukturen im Cobalt-Aluminiumoxid-Träger. Das Trägermaterial besteht aus γ-Aluminiumoxid (links; Sauerstoff: kleine, dunkelrote Kugeln ; Aluminium: große, rosafarbene Kugeln). Auf der Oberfläche des Trägers bildet sich beim Herstellungsprozess elementares Cobalt. Dieses katalysiert die Ammoniakzerlegung. Ein Teil des Cobalts wandert in den Träger und bildet einen Mischkristall (rechts). Das Cobalt ist in dieser Form (blau: CoO4) nicht mehr katalytisch wirksam.
© C. Weidenthaler, MPI für Kohlenforschung / CC BY-NC-SA 4.0
Weitere offene Fragen sind: Wohin wandert das Cobalt und in welcher Form liegt es vor? Verändert sich das Katalysator-Trägermaterial, wenn es mehrfach erhitzt wird und wieder abkühlt? Die Suche nach einer geeigneten Kombination geht in Mülheim also weiter. Eine grundsätzliche Herausforderung ist dabei, dass der Katalysator mit dem Trägermaterial keine stabilen Bindungen eingehen darf, die ihn deaktivieren. Die andere Herausforderung: Der Katalysator darf mit den Produkten und Edukten keine Wechselwirkungen eingehen, die die Reaktion behindern. Findet die Forschung hier gute, energieeffiziente Lösungen, wäre das ein großer Schritt zum Einsatz von Ammoniak als Wasserstoffspeicher.
Abbildungshinweise:
Titelbild © David Bonsen / MPI für Kohlenforschung
Abb. A: © Grafik: R. Wengenmayr nach G. Ertl / CC BY-NC-SA 4.0
Abb. B: © C. Weidenthaler; verändert nach ChemCatChem, Volume: 14, Issue: 20, 2022, DOI: (10.1002/cctc.202200688) / CC BY 4.0
Abb. C: © C. Weidenthaler, MPI für Kohlenforschung / CC BY-NC-SA 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
TECHMAX Ausgabe 10, aktualisiert im Herbst 2023; Autor: Roland Wengenmayr; Redaktion: Dr. Tanja Fendt
„Vor 73 Jahren begann das Anthropozän“, sagt Carolin Riethmüller erklärt im Film, warum wir in einem neuen Erdzeitalter leben und wie die Wissenschaft seinen Beginn festlegt.
YouTube-Link: https://youtu.be/kxrKBwsKzvY
[Dauer des Videos: 3 min]
Weitere passende Medien

© Tim Patterson
Marker und Bohrkerne aus Seen
Welche Marker sind geeignet, um die Spuren menschlicher Aktivität global nachzuweisen? Bohrkerne aus dem Crawford Lake zeigen, dass um das Jahr 1950 herum der Anteil an Plutoniumteilchen in den Sedimenten deutlich ansteigt – ein klarer Hinweis auf menschliche Einflüsse und damit auf das Anthropozän.
> Methoden der Paläoklimatologie: Bohrkerne aus Seesedimenten, Biomarker, Isotopenanalyse: GEOMAX 19

© MPG
Anthropozän
Das Anthropozän ist heute zum geflügelten Wort geworden. Es war Paul Crutzen, Nobelpreisträger und ehemals Direktor am Max-Planck-Institut für Chemie in Mainz, der den Begriff im Jahr 2000 auf einer internationalen Wissenschaftskonferenz in die Debatte einbrachte und in der Folgezeit maßgeblich prägte.
> Digital Story: Paul Crutzen und das Anthropozän
> Unterrichtsmaterial zu Paul Crutzen
Die Kernfusion gilt als eine Energiequelle der Zukunft. Aber die Entwicklungen gehen deutlich langsamer voran als vielfach angenommen. Woran liegt das? Hartmut Zohm vom MPI für Plasmaphysik erklärt in diesem Podcast, was die Herausforderungen sind.
Themen im Podcast:
Prinzip und Vorteile der Kernfusion / Wasserstoffisotope / Herausforderungen beim Bau von Fusionsreaktoren / Forschungsprojekt ITER / zukünftige Entwicklung
Zum Podcast [14 min]
Hintergrund: Verschiedene Fusionsprojekte im Überblick
Vorschau-Bild: © Matthias Otte / IPP
Bis zu zwei Dritteln des Rußes über dem zentralen Amazonas-Regenwald stammt aus Afrika. Dies ist das Ergebnis einer Studie, die jetzt in Nature Communications Earth and Environment veröffentlicht wurde. Forschende unter Leitung des Mainzer Max-Planck-Instituts für Chemie und der Universität von Sao Paulo unterschieden Rußpartikel anhand ihrer Eigenschaften und ordneten sie ihren Quellen zu. Sie fanden heraus, dass Buschfeuer und brennende Savannen im nördlichen und südlichen Afrika das ganze Jahr über erheblich zur Luftverschmutzung in Zentralamazonien beitragen, und damit auch eine wichtige Rolle im atmosphärischen Strahlungshaushalt und im Wasserkreislauf spielen. Ursache ist ein effizienter transatlantischer Partikeltransport durch die Atmosphäre.
Im Kurzfilm (2 min) erklärt Cedric Engels die Erkenntnisse aus der Forschung. Zum Film in YouTube
Das passende GEOMAX-Heft greift Ursachen und Folgen der Waldbrände am Amazonas auf. Max-Planck-Teams untersuchen die Auswirkungen der Feuer auf die Atmosphäre und das Klima und erklären die Rolle des Regenwaldes im Klimageschehen und seine Gefährdung.
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.
YouTube-Link: https://youtu.be/NUONLjkEi1Y
[Dauer des Videos: 2 min]