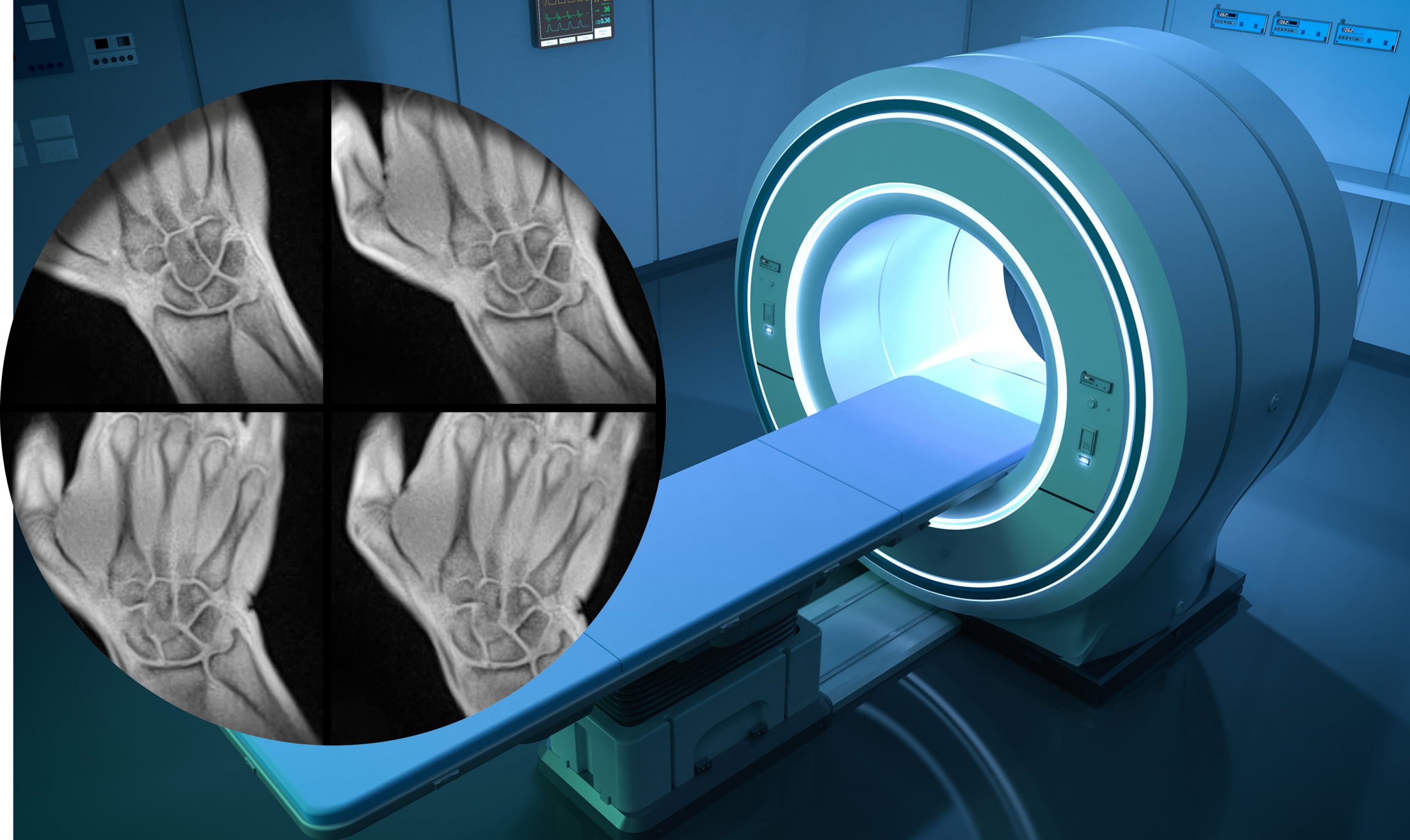
Techmax 33: Liveschaltung in den Körper
plus Shipping Costs
Neue Einblicke mit der Echtzeit-MRT
Die Magnetresonanztomographie, kurz MRT, gehört längst zum medizinischen Alltag: Nach Sportverletzungen oder Unfällen, auf der Suche nach Tumoren oder zur Untersuchung des Gehirns nutzen Ärztinnen und Ärzte die Bilder, die die MRT produziert. Bisher mussten sie sich dabei allerdings mit Standbildern zufriedengeben. Doch der Arbeitsgruppe von Jens Frahm am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften gelingt es, mit der MRT Videos aufzunehmen. Die Aufnahmen in Echtzeit ermöglichen der Medizin neue Einblicke, zum Beispiel in das schlagende Herz, Gelenke in Bewegung oder die komplexen Vorgänge beim Singen, Sprechen oder Schlucken.
Nach einem schweren Sportunfall landet man oftmals in der Röhre. Während man in der Enge liegt, kann man dem Magnetresonanztomographen bei der Arbeit zuhören: es brummt und klackt und summt. Nach der Untersuchung sichtet ein Arzt oder eine Ärztin die hochaufgelösten Schwarzweißbilder, auf denen die unterschiedlichen Gewebe klar zu unterscheiden sind und ihre Struktur gut zu erkennen ist. So wird festgestellt, ob durch den Unfall Bänder oder Sehnen in Mitleidenschaft gezogen wurden. Neben der Orthopädie kommt das Bildgebungsverfahren auch in vielen anderen Bereichen der Medizin zum Einsatz, zum Beispiel auf der Suche nach Tumoren oder bei der Untersuchung des Gehirns. Doch was passiert eigentlich, während man in der Röhre liegt? Wie entstehen die Bilder und wie unterscheidet sich das Verfahren von Röntgen und Ultraschall? Der Physiker Jens Frahm vom Max-Planck-Institut für Multidisziplinäre Naturwissenschaften war bei der Entwicklung der Magnetresonanztomographie von Anfang an dabei und sorgte dafür, dass sie die nötige Geschwindigkeit für den klinischen Alltag erreichte.
Rotierende Kerne
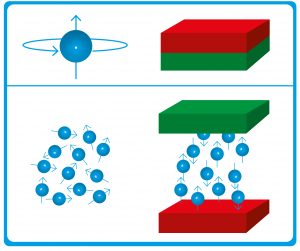
Abb. A: Kernresonanz. Kernspin und damit kernmagnetischer Dipol (oben) der Wasserstoffatomkerne des Körpers sind ohne äußeres Magnetfeld ungeordnet (unten links). Wird ein starkes statisches Magnetfeld angelegt, so richten sich die kernmagnetischen Dipole entlang der Feldlinien aus (unten rechts).
© HNBM, MPG / CC BY-NC-SA 4.0
Der grundlegende physikalische Effekt hinter der MRT ist die magnetische Kernresonanz. Über 60 Prozent der Atome im menschlichen Körper sind Wasserstoffatome. Und deren Kerne haben einen Eigendrehimpuls, auch Kernspin genannt. Den Kern mit Eigendrehimpuls kann man sich wie einen Ball vorstellen, der sich um sich selbst dreht. Da die Wasserstoffkerne Protonen und damit durch den Kernspin bewegte Ladungen sind, erzeugen sie ein Magnetfeld. Der entstehende kernmagnetische Dipol richtet sich in einem von außen angelegten statischen Magnetfeld entlang der Feldlinien aus (Abb. A). In einem MRT-Gerät wird durch supraleitende Spulen (siehe Techmax 5) ein üblicherweise 1 bis 3 Tesla starkes statisches Magnetfeld erzeugt, das die Wasserstoffkerne im Körper der untersuchten Person ausrichtet. Dadurch entsteht eine makroskopische Magnetisierung entlang der Längsachse der Röhre (Abb. B). Ein elektromagnetisches Wechselfeld kann die Magnetisierung aus dieser Richtung auslenken. Damit das Wechselfeld die Magnetisierung kippen kann, muss seine Frequenz der Resonanzfrequenz entsprechen. Diese ist vom Atomkern und der Stärke des angelegten statischen Magnetfelds abhängig. Für Protonen bei 1 Tesla beträgt sie 42,58 MHz und liegt im UKW-Radiowellenbereich. Nach der Kippung kehrt die Magnetisierung langsam wieder in die Ausgangslage zurück. Dabei erzeugt sie ein elektromagnetisches Wechselfeld, das eine Spannung in einer Messspule induziert und so aufgezeichnet wird. Die Stärke des Signals weist auf die Protonendichte im Gewebe hin, während die Zeit bis zum Abklingen des Signals charakteristisch für die chemische Bindung der Wasserstoffatome und deren molekulare Umgebung ist.
Vom Signal zum Bild
Im Magnetresonanztomographen regt man also die magnetische Kernresonanz der Wasserstoffatome im Gewebe an, um Signale und damit Informationen aus dem Körper zu erhalten. Doch wie kann das Signal einem exakten Ort zugeordnet werden und wie setzt sich aus einer Vielzahl derartiger Informationen ein Bild zusammen? Hier kommt der zweite Teil des Namens der Bildgebungsmethode ins Spiel, die Tomographie, was Schnittbild oder Schichtaufnahme bedeutet. Bei der MRT wird somit eine ausgewählte Schicht des Körpers dargestellt. Die sogenannte Ortskodierung ermöglicht es, aus den Messdaten Abbilder des Untersuchungsobjekts zu berechnen. Dazu werden zusätzlich zum statischen magnetischen Feld weitere Magnetfelder angeschaltet, die sich in ihrer Stärke entlang einer Achse unterscheiden. Man spricht von Gradientenfeldern (Abb. B). In der MRT werden klassisch drei senkrechte Gradientenfelder verwendet, die es möglich machen, ein Signal genau seinem Ursprungsort zuzuordnen. Der erste Gradient wählt die Schicht aus, die abgebildet werden soll, und die beiden anderen Gradienten erzeugen ein Gitter, wodurch Signale Bildpunkten zugeordnet werden können (Abb. B). Dabei macht man sich zunutze, dass ein zusätzliches Magnetfeld die Resonanzfrequenz der Wasserstoffkerne ändert und man so eine Schicht zur Anregung auswählen bzw. anschließend nachvollziehen kann, von welchem Ort ein Signal stammt. Die exakte Schaltung von Gradienten- und Wechselfeldern hängt vom spezifischen Verfahren ab und ist hochkomplex. Doch allgemein gilt: Um ein vollständiges Schichtbild zu erhalten, müssen die Gradientenfelder so oft an und wieder ausgeschaltet werden, wie das Bild letztlich Zeilen bzw. Bildpunkte in einer Dimension haben soll. Meist werden in der MRT Bilder mit bis zu 512 x 512 Bildpunkten aufgenommen. Damit die Aufnahme möglichst schnell abläuft, werden die zur Ortskodierung eingesetzten Gradientenfelder sehr schnell geschaltet, wodurch die lauten Geräusche in der Röhre entstehen.
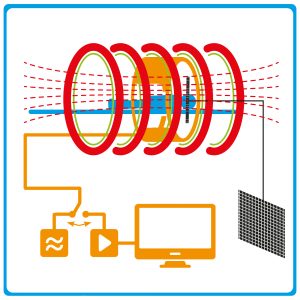
Abb. B: Magnetresonanztomograph. Die zu untersuchende Person wird in der Röhre positioniert. Die äußersten Spulen (rot) erzeugen das starke statische Magnetfeld, das die Kernspins der Wasserstoffkerne ausrichtet. Die Spulen für die Gradientenfelder (grün) schalten kurzzeitig weitere (statische) Magnetfelder für die Ortskodierung zu. Radiofrequenzspulen (orange) erzeugen das magnetische Wechselfeld zur Auslenkung der Magnetisierung und dienen als Empfängerspulen für die Signale.
© HNBM, MPG / CC BY-NC-SA 4.0
Mittels komplexer mathematischer Verfahren lässt sich dann aus der großen Datenmenge der vielen Einzelmessungen ein zweidimensionales Schnittbild berechnen. Bis Mitte der 1980er Jahre dauerte die Aufnahme eines Schnittbildes ca. 5 Minuten, eine dreidimensionale Messung des Körpers mit beispielsweise 256 x 256 x 256 Bildpunkten sogar mehrere Stunden. Da sich während dieser Zeit der Patient auch nicht bewegen durfte, führte das dazu, dass die MRT im klinischen Alltag selten eingesetzt wurde. Doch 1985 gelang Jens Frahm und seinem Team ein Durchbruch. „Durch FLASH eliminierten wir die Wartezeit zwischen den Einzelmessungen und beschleunigten die MRT so um einen Faktor größer 100. Plötzlich konnten einzelne Schichtbilder in Sekundenschnelle aufgenommen werden und dreidimensionale Aufnahmen dauerten nur noch wenige Minuten“, sagt Jens Frahm. Das patentierte FLASH-Verfahren wurde innerhalb eines halben Jahres von allen Herstellern von MRT-Geräten übernommen und kommt heute in allen kommerziellen Geräten zum Einsatz. Dank der Geschwindigkeit des neuen Verfahrens etablierte sich die MRT in der diagnostischen Bildgebung.
MRT vs. Röntgen und Ultraschall
Doch warum ist die MRT in der Medizin eigentlich so gefragt? Mit Röntgen, Computertomographie (CT) und Sonographie waren ja bereits verschiedene Bildgebungsverfahren etabliert. Welche Vorteile bietet die MRT gegenüber diesen Methoden? Beim Röntgen nutzt man die kurzwellige elektromagnetische Röntgenstrahlung. Diese wird von der einen Seite auf die zu untersuchende Körperpartie gestrahlt und auf der anderen Seite detektiert. Je mehr Gewebe zwischen Strahlungsquelle und Detektor liegt und je dichter dieses Gewebe ist, desto mehr Röntgenstrahlung wird absorbiert oder gestreut. Dichte anatomische Strukturen wie Knochen heben sich somit hell gegen die dunkleren Weichteile wie Muskeln ab. Knochenbrüche können so zum Beispiel leicht diagnostiziert werden. Unterschiedliche weiche Gewebe lassen sich durchs Röntgen nur schwer unterscheiden, da hierzu der Kontrast nicht ausreichend ist. Die Computertomographie basiert auch auf Röntgenstrahlung, ermöglicht aber statt einer Durchleuchtung eine Schichtbildgebung und 3D-Aufnahmen. Da die kurzwellige Röntgenstrahlung ionisierend auf biologisches Gewebe wirkt, besteht durch die Strahlenbelastung ein erhöhtes Krebsrisiko. Deshalb wird bei einer Untersuchung nur die betreffende Stelle geröntgt und empfindliche Körperpartien werden durch eine Bleischürze geschützt. Die Strahlenbelastung verbietet es außerdem, Videos mit vielen Bildern pro Sekunde mit Röntgenapparat oder CT aufzunehmen.
Bei der Sonographie werden mechanische Ultraschallwellen in den Körper gesandt und deren Echo aufgezeichnet. Mit der Sonde, die den Ultraschall aussendet und detektiert, wird über die betreffenden Körperstellen gefahren. Aus der Laufzeit und der Amplitude des Echos berechnet ein Computer dann in Echtzeit Bilder. Von der Sonde werden die Ultraschallwellen fächerartig in den Körper ausgesandt. So entsteht typischerweise ein Schnittbild entlang der Ebene dieses Fächers. Moderne Geräte ermöglichen aber auch 3D-Bilder. Je stärker ein Gewebe den Schall zurückwirft, desto heller erscheint es auf den Bildern. Dadurch entsteht der Kontrast im Bild. Da die Eindringtiefe des Ultraschalls begrenzt ist, werden tief liegende oder verdeckte anatomische Strukturen kaum oder nicht aufgelöst. Dies schränkt die Nutzung der Sonographie ein. Je nach medizinischer Fragestellung können Ärztinnen und Ärzte einzelne Bilder aufnehmen oder in Echtzeit mit Videobildrate das Geschehen im Körper verfolgen. Die sonographische Untersuchung hängt in ihrer Qualität stark vom Untersuchenden ab und ist schlecht wiederholbar. Vorteil der Sonographie ist, dass sie nichtinvasiv und risikoarm ist, weshalb sie beispielsweise in der Schwangerschaftsvorsorge eingesetzt wird.
Stärken der MRT sind der hervorragende Weichteilkontrast und die hohe räumliche Auflösung. So entstehen scharfe Bilder des gesamten Körperinneren. Außerdem sind sowohl die Radiowellen als auch die statischen Magnetfelder gesundheitlich unbedenklich. Ganzkörperscans oder wiederholte Untersuchungen bedeuten also kein zusätzliches gesundheitliches Risiko. Seit der Einführung von FLASH hat sich die Geschwindigkeit der MRT lange Zeit nicht verändert. Das bedeutete, dass zwar MRT-Aufnahmen im medizinischen Alltag kein Problem, aber MRT-Videos bewegter Vorgänge aus dem Körperinneren ein Ding der Unmöglichkeit waren: An Videos mit Bildraten von 20 Bildern pro Sekunde oder mehr war nicht zu denken. „Nach der Entwicklung von FLASH sahen wir zunächst keine weitere Möglichkeit, die MRT zu beschleunigen“, sagt Jens Frahm. Doch die Idee einer noch schnelleren MRT spukte ihm weiter im Kopf herum.
Echtzeit durch Hochleistungsrechner
Bis es soweit war, dauerte es 25 Jahre. Aber seit dem Durchbruch, den Jens Frahm mit seinem Team 2010 feierte, kann er sagen: „Wir haben es geschafft, die MRT-Bildgebung weiter zu beschleunigen! So ist uns sozusagen der Schritt vom Foto zum Film gelungen. Und das eröffnet ganz neue diagnostische Möglichkeiten, zum Beispiel weil das schlagende Herz genau dargestellt werden kann.“ Im Vergleich zur MRT vor 1985 gelang es Jens Frahm und seinem Team, die Aufnahmegeschwindigkeit insgesamt um einen Faktor 10.000 zu steigern. Nun können die Forschenden Schichtbilder mit einer Bildrate von bis zu 100 Bildern pro Sekunde aufnehmen. Sie nennen ihre Technik Echtzeit-MRT. „Möglich gemacht haben diese Entwicklung zum einen Fortschritte in der numerischen Mathematik und zum anderen die Verfügbarkeit von leistungsstarken Grafikkartenrechnern“, erläutert Jens Frahm. Denn die Beschleunigung des Verfahrens beruht nicht wie bei FLASH darauf, dass die Einzelmessungen schneller werden. „Wir messen einfach weniger oft und nutzen dann ein neues mathematisches Verfahren, um aus den für eine klassische Berechnung ungenügenden Daten ein aussagekräftiges Bild zu erzeugen.“ Dazu wenden die Forschenden die radiale Ortskodierung an (Abb. C).
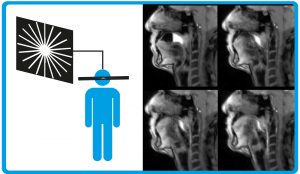
Abb. C: Echtzeit-MRT durch radiale Ortskodierung: Anstatt wie herkömmlich durch die Gradientenfelder ein Gitter zu erzeugen, laufen die verwendeten radialen Gradienten wie Speichen durch die Mitte eines Rades (links). Dabei werden für jedes Schichtbild aber weniger Einzelmessungen als nötig aufgenommen. Die fehlenden Informationen werden anschließend durch die Lösung eines komplexen mathematischen Problems ermittelt. So lassen sich z.B. Videos des Schluckvorgangs mit einer Zeitauflösung von nur 40 ms aufnehmen. Auf den Einzelbildern aus dem Video hebt sich die getrunkene Flüssigkeit weiß ab (rechts).
© links: HNBM, MPG / CC BY-NC-SA 4.0; rechts © J. Frahm et al.: Real-Time Magnetic Resonance Imaging. Investigative Radiology, Vol. 54, Nr. 12, 2019
Entscheidend ist, dass für jedes Schichtbild je nach Anwendung um einen Faktor 10 bis 40 weniger Einzelmessungen durchgeführt werden als eigentlich nötig. Dadurch wird die Aufnahme genau um diesen Faktor schneller. Die fehlenden Informationen werden anschließend durch die Lösung des nichtlinearen inversen Problems rekonstruiert. Durch dieses mathematische Verfahren wird das Bild nicht direkt aus den Daten rekonstruiert, sondern ausgehend von einem Startbild – üblicherweise dem letzten aufgenommenen Bild – geschätzt. Aus dem geschätzten Bild lassen sich die Daten berechnen, die die Messspulen aufgenommen haben müssten, um dieses zu erzeugen. Und die kann man wiederum mit den tatsächlich aufgenommenen Daten abgleichen. In einem schrittweisen Prozess kann das geschätzte Bild so optimiert werden, dass es möglichst genau zu den Messwerten passt. Das klappt dank der Entwicklungen von Jens Frahms Team so gut, dass die Bildqualität ausreichend für die medizinische Diagnostik ist. Da dieser Ablauf die eigentliche Bildentstehung in der MRT auf den Kopf stellt, spricht man von einem inversen Problem. Die Lösung dieses Problems und damit die Echtzeit-MRT erfordert eine sehr große Rechenleistung. Was sie allerdings nicht benötigt, ist ein besonderes MRT-Gerät. So könnten alle bereits in Kliniken vorhandenen Geräte durch einen leistungsfähigen Grafikkartenrechner für die Datenverarbeitung erweitert werden.
Live-Videos aus dem Körper
Der Echtzeit-MRT eröffnen sich viele Anwendungsfelder: So kann ein Kardiologe direkt das schlagende Herz beobachten und beispielsweise Herzrhythmusstörungen genau analysieren. Auch das Schlucken und Schluckbeschwerden können durch die Echtzeit-MRT erstmals untersucht werden (Abb. C). Neben klassischen medizinischen Anwendungen ist Jens Frahm auch auf großes Interesse in der Musik und Phonetik gestoßen: Wie genau werden beim Sprechen Töne erzeugt? Wie beim Beatboxen? Und was unterscheidet einen herausragenden Hornisten von einem Anfänger oder Fortgeschrittenen? Durch die neuen Möglichkeiten der Echtzeit-MRT können beispielsweise die Bewegungen der Zunge im Mundraum genau untersucht und quantifiziert werden.
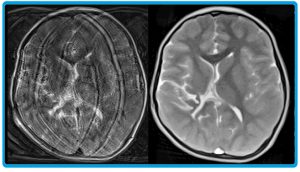
Abb. D: Messen in Millisekunden. Schichtbild aus dem Gehirn eines 4 Jahre alten Kindes. Links: Die herkömmliche MRT mit einer Messzeit von 38 s liefert ein verschwommenes Bild, da sich das Kind offensichtlich während der Messung bewegt hat. Rechts: Die Echtzeit-MRT mit einer Messzeit von 50 ms erzeugt ein scharfes Bild, das zur Diagnostik genutzt werden kann.
© Verändert nach: D. Gräfe et al.: Outpacing movement — ultrafast volume coverage in neuropediatric magnetic resonance imaging. Pediatr Radiol 50, 2020. / CC BY 4.0
Die neue Methode beschleunigt auch die Untersuchung ganzer Körperteile mittels überlappender Schichtbilder, die nun in nur wenigen Sekunden gemessen werden (Abb. D). Dies ist gerade in der Kinderheilkunde ein großer Vorteil. Denn Säuglinge und Kleinkinder halten nicht lange genug still, um mit der konventionellen MRT beispielsweise eine vollständige Bildgebung des Schädels durchzuführen. Daher ist bisher oft eine risikobehaftete Narkose notwendig. „Unsere Kooperationspartner an der Universitätsklinik Leipzig haben in den letzten Jahren festgestellt, dass mit der Echtzeit-MRT in mindestens der Hälfte aller Fälle keine Narkose notwendig ist“, sagt Jens Frahm.
Der Forscher ist an seinem Ziel angekommen: Live-Videos aus dem Körper dank MRT. Und seit dem Durchbruch 2010 zeigte sich, dass die beschleunigte Methode zahlreiche neue Anwendungen ermöglicht. „Wir müssen aber erst lernen, die Echtzeit-MRT diagnostisch zu nutzen. Auch für das medizinische Personal ergeben sich neue Anforderungen und notwendige Erprobungsphasen. Die technischen Fortschritte müssen in belastbare Untersuchungsprotokolle ‚übersetzt’ werden, die die jeweiligen medizinischen Fragestellungen optimal beantworten.“
Abbildungshinweise:
Titelbild © J. Frahm , Investigative Radiology, Vol. 54 , Nr. 12 , 2019; istockphoto.com
Abb. A: © HNBM, MPG / CC BY-NC-SA 4.0
Abb. B: © HNBM, MPG / CC BY-NC-SA 4.0
Abb. C: links: HNBM, MPG / CC BY-NC-SA 4.0; rechts © J. Frahm et al.: Real-Time Magnetic Resonance Imaging. Investigative Radiology, Vol. 54, Nr. 12, 2019
Abb. D: © Verändert nach: D. Gräfe et al.: Outpacing movement — ultrafast volume coverage in neuropediatric magnetic resonance imaging. Pediatr Radiol 50, 2020. / CC BY 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
TECHMAX Ausgabe 33, Frühjahr 2023; Autor: Dr. Andreas Merian; Redaktion: Dr. Tanja Fendt