Biomax 37: Grünes Tuning
plus Shipping Costs
Auf dem Weg zur künstlichen Fotosynthese
Eine Herausforderung des 21. Jahrhunderts ist die Eindämmung des Klimawandels. Und das heißt, dass es uns gelingen muss, den Anteil von Treibhausgasen in der Atmosphäre zu reduzieren. Kohlenstoffdioxid aus der Luft mithilfe von Sonnenenergie nutzbar machen – diesen Prozess beherrschen Pflanzen bereits seit Jahrmillionen. Eröffnet die künstliche Fotosynthese einen Weg, um aus Kohlenstoffdioxid mithilfe von Licht nachhaltig Rohstoffe zu produzieren? Ein Team um Tobias Erb, Direktor am Max-Planck-Institut für terrestrische Mikrobiologie in Marburg, arbeitet daran, diesen Prozess so zu „tunen“, dass er mehr Kohlenstoff binden kann. Mit ihrem synthetisch-biologischen Ansatz wollen die Max-Planck-Forschenden biologische Prozesse jedoch nicht nur schrittweise verbessern, sondern auch ganz neue Lösungen umsetzen, die in dieser Form in der Natur nicht zu finden sind – eine Idee mit vielversprechendem Potenzial.
Jedes Jahr holen Fotosynthese treibende Organismen rund 400 Gigatonnen Kohlenstoffdioxid (CO2) aus der Luft. Im natürlichen Kohlenstoffkreislauf entsprach das genau der Menge an CO2, die durch geologische und biologische Prozesse wieder freigesetzt wurde – bis mit Beginn des Industriezeitalters (etwa um 1750) der Mensch anfing, zunehmend fossile Brennstoffe wie Kohle, Erdöl und Erdgas, in denen der Kohlenstoff aus Jahrtausenden bis Jahrmillionen unterirdisch gespeichert war, zu verbrennen. Dadurch bringen wir den Kohlenstoffkreislauf zunehmend aus dem Gleichgewicht: Aktuell emittieren wir jährlich 38 Gigatonnen CO2 zusätzlich, also knapp ein Zehntel des natürlichen Kreislaufs (siehe GEOMAX 22). Ein Verfahren, welches das überschüssige Kohlenstoffdioxid wieder aus der Atmosphäre entfernt und gleichzeitig noch sinnvoll nutzt, wäre also hochwillkommen. Tobias Erb, Direktor am Max-Planck-Institut für terrestrische Mikrobiologie treibt aber nicht primär der Kampf gegen den Klimawandel an. Zunächst einmal will er verstehen, wie sich Kohlenstoffdioxid in organische Moleküle umwandeln lässt. „Wenn wir das Treibhausgas mit biologischen Methoden als Kohlenstoffquelle erschließen und dabei aus der Atmosphäre entfernen könnten, wäre das natürlich ein toller Nebeneffekt“, sagt der Max-Planck-Forscher.
Zentral für das Leben
Evolutionär betrachtet ist die Fotosynthese ein ausgesprochen erfolgreicher biochemischer Prozess und sehr gut in der Lage, die Anforderungen der biologischen Funktionen zu erfüllen: Einfach zusammengefasst, wandelt sie das CO2 aus der Luft mithilfe von Sonnenenergie und Wasserstoff in Kohlenhydrate um. Um Wasserstoff zu gewinnen, müssen Pflanzen dabei Wassermoleküle spalten. Den überschüssigen Sauerstoff gibt die Pflanze an die Umwelt ab. Ein Teil der Kohlenhydrate liefert die nötige Energie zum Leben, der andere Teil wird zum Grundbaustein für die Produktion großer Biomoleküle. Mit diesen wächst die Biomasse an – die Pflanze speichert so den Kohlenstoff aus der Atmosphäre.
Der Prozess hat aber auch seine Grenzen. So beträgt die Effizienz der Umwandlung von eingestrahltem Sonnenlicht in Biomasse bei der biologischen Fotosynthese (ohne den Eigenverbrauch der Pflanze) gerade mal ein Prozent. Das ist nichts im Vergleich zu gängigen Fotovoltaikanlagen, die rund 20 Prozent der eingesammelten Sonnenenergie in elektrische Energie umwandeln. Ein Flaschenhals für die Effizienz ist die Transpiration der Pflanzen. Über die Spaltöffnungen der Blätter, die sogenannten Stomata, nehmen Pflanzen nicht nur das CO2 aus der Luft auf, sondern verdunsten dabei gleichzeitig auch Wasser. Die Verdunstung verbraucht jedoch wesentlich mehr Wasser als die Fotosynthese-Reaktion. Indem die Pflanze den Verlust an Wasser begrenzt, schränkt sie auch den Gasaustausch und die Fotosyntheseleistung ein.
Begrenzte Leistung
Als einen weiteren limitierenden Faktor hat Axel Kleidon, Forschungsgruppenleiter am Max-Planck-Institut für Biogeochemie, die Thermodynamik ausgemacht. Als Erdsystemforscher untersucht er wichtige chemische, geologische und physikalische Prozesse und Stoffkreisläufe auf der Erde. Das erfordert einen Blick auf das Große und Ganze: „Der CO2-Transport an die Blätter erfolgt durch die große Umwälzanlage der Thermik, indem erwärmte, befeuchtete und CO2-ärmere Luft vom Boden aufsteigt und kühlere, trockenere und CO2-reichere Luft absinkt“, erklärt Kleidon. Der Motor dafür ist die Erwärmung der Erdoberfläche durch die Sonnenstrahlung. Dadurch entsteht ein Temperaturunterschied, der eine atmosphärische Wärmekraftmaschine antreibt. „Diese Maschine leistet so viel wie möglich, sie begrenzt aber auch die Verdunstung und damit den Nachschub an CO2 für die Fotosynthese“, so der Physiker. Denn der Wärmefluss, der die Maschine antreibt, baut auch den Temperaturunterschied wieder ab und reduziert so ihren Wirkungsgrad. Die biologische Fotosynthese ist also immer nur so effektiv, wie der thermodynamisch geleistete Nachschub. „Natürliche Ökosysteme und auch die Landwirtschaft operieren schon nah an ihrer Leistungsgrenze, substanzielle Steigerungen sind hier kaum zu erwarten“, betont Kleidon daher.

Abb. D: Der heutige Chloroplast hat sich in 3,5 Milliarden Jahren zu einer effizienten molekularen Maschine entwickelt.
© Science History Images / Alamy Stock

Abb. D: Der künstliche Chloroplast wurde in weniger als 7 Jahren entworfen und realisiert (grün: Thylakoidmembranen).
© T. Erb / MPI für terrestrische Mikrobiologie
Die Biologie lässt sich nicht weiter optimieren, wenn die Physik ihr Grenzen setzt. Aber die heute gut erforschten fotosynthetischen Prozesse in Pflanzen, Algen und Bakterien können als Vorbild dienen für die Entwicklung einer künstlichen Fotosynthese. Der künstliche Nachbau der Fotosynthese gilt dabei als eine Art „Apollo-Projekt“ unserer Zeit: Damit ließen sich Kohlenstoffverbindungen nachhaltig mithilfe von Licht aus Kohlenstoffdioxid herstellen. Sonnenlicht wäre dafür die ultimative Ressource, denn die Sonne sendet ungefähr 15.000-mal mehr Energie zur Erde als die Menschheit verbraucht. Die technische Umsetzung der beiden Teilprozesse der Fotosynthese, der Primär– und der Sekundärreaktion, befindet sich dabei in unterschiedlichen Entwicklungsstadien. Für die Primärreaktion wurden fotovoltaische Lösungen realisiert, die hinsichtlich der Photonenausbeute dem natürlichen Prozess entsprechen. Für die technische Umsetzung der Sekundärreaktion konnte bisher keine mit dem natürlichen System konkurrierende katalytische Lösung gefunden werden. Doch genau das ändert sich gerade – dank der Forschungsarbeiten von Tobias Erb.
Die Umwandlung von atmosphärischem CO2 in energetisch höherwertige Kohlenstoffverbindungen erfolgt in Pflanzen über den nach seinem Entdecker benannten Calvin-Zyklus. Der US-amerikanische Biochemiker Melvin Calvin verfolgte mit seiner Arbeitsgruppe an der University of California in Berkeley Ende der 1940er Jahre, wie aus radioaktiv markiertem Kohlenstoffdioxid in einem Kreisprozess Kohlenhydrate hergestellt wurden. 1961 erhielt er für diese Arbeiten den Nobelpreis für Chemie. Für den Ablauf der chemischen Reaktionen, die im Stroma der Chloroplasten stattfinden, werden als Voraussetzung lediglich ATP als Energiequelle und NADPH/H+ als Reduktionsmittel benötigt. Das zentrale Enzym, das die Bindung von CO2 katalysiert, heißt Ribulose-1,5-bisphosphatcarboxylase/-oxygenase, kurz Rubisco (Abb. A). Es ist eines der häufigsten Proteine der Natur. „Nimmt man das Proteom, also alle Proteine zusammengefasst in einem Blatt, so besteht das zu fünfzig Prozent aus Rubisco“, erklärt Tobias Erb.
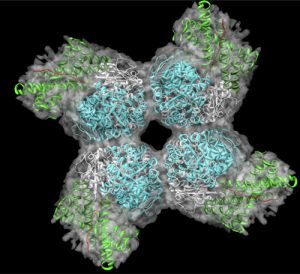
Abb. A: Das CO2-bindende Enzym des Calvin-Zyklus heißt Rubisco. Es ist sehr komplex gebaut und besteht aus 16 Untereinheiten. Auf jeden Menschen kommen etwa fünf Kilogramm Rubisco. Aus dem Kohlenstoffdioxid, das im Volumen eines gewöhnlichen Wohnzimmers vorhanden ist, kann die Pflanze mithilfe des Enzyms eine Prise Zucker produzieren.
© Grafik: A. Bracher / MPI für Biochemie
Dabei ist Rubisco keine optimale Lösung, wenn es um die Effizienz der Kohlenstofffixierung geht. Denn trotz seiner wichtigen Rolle arbeitet Rubisco relativ langsam: Ein Molekül kann nur etwa fünf bis zehn CO2-Moleküle in der Sekunde umsetzen. Und es ist sehr ineffizient, da es nicht nur CO2 bindet, sondern auch Sauerstoff. Als Rubisco vor rund drei Milliarden Jahren entstand, war das noch kein Problem – da gab es nämlich noch keinen Sauerstoff in der Atmosphäre. Als sich dieser jedoch mehr und mehr anreicherte, konnte sich das Enzym dieser Veränderung nicht anpassen. Zwanzig Prozent der Reaktionen laufen unerwünscht mit dem Sauerstoff ab. Die Pflanzenzelle kann mit dem daraus entstehenden toxischen Produkt nichts anfangen. Sie muss es in einem aufwändigen Prozess, der sogenannten Photorespiration, umwandeln, wobei wiederum CO2 freigesetzt wird. Dieser Prozess verpulvert bis zu einem Drittel der durch die Fotosynthese eingefangenen Energie – was die Pflanzen sich aber angesichts der unbegrenzten Verfügbarkeit von Sonnenenergie leisten können.
Stoffwechsel 2.0
Tobias Erb setzt derweil auf eine effizientere Alternative zu Rubisco, die er vor einigen Jahren mit seinem Team im Bodenbakterium Kitasatospora setae entdeckt hat. Das betreibt zwar keine Fotosynthese, musste aber lernen, seinen Bedarf an Kohlenstoff in einer kohlenstoffarmen Umwelt zu decken. Dazu entwickelte dieses Bakterium eine höchst wirksame Klasse von Enzymen mit dem Namen Enoyl-CoA Carboxylase/Reduktase, kurz ECR. Sie können das Kohlenstoffdioxid etwa zwanzigmal schneller verarbeiten als das pflanzliche Rubisco – nicht zuletzt deshalb, weil dabei auch kaum Fehler auftreten.
Dieser Fund brachte Erb auf die Idee, eine künstliche, hocheffiziente Alternative zum Calvin-Zyklus quasi neu zu erfinden und dabei Hochleistungsenzyme wie ECR zu nutzen. Die Herausforderung bestand darin, dass an dem Prozess noch ein gutes Dutzend anderer Enzyme beteiligt sind, die fein aufeinander abgestimmt sein müssen. Entfernt man auch nur eines davon, dann bricht der biochemische Prozess zusammen. „Das Enzym ist eigentlich nur so etwas wie ein neues Computerprogramm“, erklärt Erb. „Damit es aber funktioniert, mussten wir – um im Bild zu bleiben – ein komplettes neues Betriebssystem aufbauen.“ Dazu suchte das Team Enzyme zusammen, die jeweils ihre Aufgabe im „Betriebssystem“ möglichst optimal erledigen (Abb. B). Sie fanden sich in so unterschiedlichen Organismen wie Purpurbakterien, Gänserauke und sogar der menschlichen Leber. Einige Enzyme mussten auch chemisch umgebaut werden. Das Ergebnis nennt sich „CETCH-Zyklus“. Es ist der erste künstliche Stoffwechselweg zur biologischen CO2-Fixierung. Mit 15 bis 17 Einzelschritten ist er vergleichbar komplex wie sein natürliches Vorbild, arbeitet aber wesentlich effizienter und zudem fehlerfrei: Theoretische Berechnungen zeigen, dass der CETCH-Zyklus lediglich 24 bis 28 Lichtquanten pro fixiertem, also gebundenem CO2-Molekül benötigt. Verglichen mit der natürlichen Sekundärreaktion in Pflanzen (ca. 34 Lichtquanten pro CO2-Molekül) braucht der künstliche Stoffwechselweg damit bis zu 20 Prozent weniger Lichtenergie. Im Reagenzglas sei der Designer-Stoffwechselweg bereits funktionsfähig, so der Max-Planck-Forscher. Zu den aufgereinigten Proteinen, die beteiligt seien, müsse man noch ATP als Energielieferant hinzugeben, und der CETCH-Zyklus laufe los.
Fotosynthese im Reagenzglas
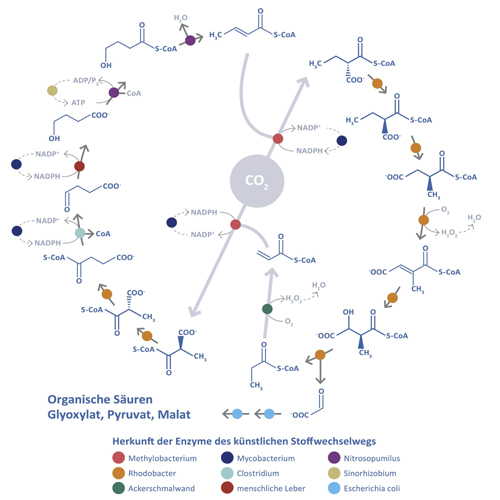
Abb. B: Entwurf und die Realisierung künstlicher Stoffwechselwege zur effizienteren CO2-Reduktion mithilfe der synthetischen Biologie: Der CETCH-Zyklus besteht aus 17 verschiedenen Enzymen, die aus insgesamt neun verschiedenen Organismen (farblich gekennzeichnet) stammen. Drei dieser Enzyme wurden mit Computerunterstützung maßgeschneidert, um eine entsprechende Reaktion zu katalysieren.
© acatech / Leopoldina / Akademienunion auf Grundlage von T. Erb
Praktisch musste das Marburger Team dies erst einmal in einem künstlichen Fotosynthesesystem beweisen. Doch wie konstruiert man eine künstliche fotosynthetisch aktive Zelle? „Als allererstes benötigten wir ein Energiemodul, das es uns erlaubt, chemische Reaktionen nachhaltig zu betreiben. Bei der Fotosynthese liefern Chloroplasten-Membranen die Energie für die Kohlenstoffdioxid-Fixierung. Ihre Fähigkeiten wollten wir nutzen“, erklärt Erb. Der aus der Spinatpflanze isolierte Fotosynthese-Apparat zeigte sich robust genug, um auch im Reagenzglas die Energie aus dem Licht, die Elektronen und den Wasserstoff bereitzustellen. Für die Sekundärreaktion setzten die Forschenden den von ihnen selbst entwickelten CETCH-Zyklus ein (Abb. D). Nach mehreren Optimierungsrunden gelang dem Team tatsächlich die lichtgesteuerte Fixierung des Treibhausgases Kohlenstoffdioxid in vitro. „Mit der Plattform können wir neuartige Lösungen umsetzen, die die Natur während der Evolution nicht beschritten hat“, sagt Erb. Nach seiner Einschätzung bergen die Ergebnisse großes Zukunftspotenzial. So konnten die Forschenden zeigen, dass der künstliche Chloroplast mithilfe der neuartigen Enzyme und Reaktionen Kohlenstoffdioxid 100-mal schneller bindet als bisherige synthetisch-biologische Ansätze. „Langfristig könnten lebensechte Systeme in praktisch allen technologischen Bereichen Anwendung finden, einschließlich Materialwissenschaften, Biotechnologie und Medizin“, hofft der Max-Planck-Forscher.
Noch sind die künstlichen Chloroplasten nur feine Wassertröpfchen von knapp 100 Mikrometern Durchmesser, die in einer Ölemulsion schwimmen (Abb. C). Sie sind nur zwei Stunden lang stabil. Trotzdem können sie erstaunlicherweise selbstständig aus dem gebundenen Kohlenstoff messbare Mengen der Verbindung Glykolat herstellen. Daraus lassen sich bereits eine Vorstufe des Antibiotikums Erythromycin oder ein Duftstoff auf Terpen-Basis herstellen, wie Erbs Team zeigen konnte.
Grüne Fabriken
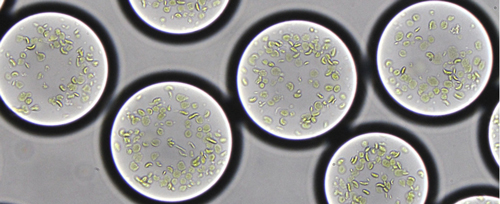
Abb. C: Diese Tröpfchen haben 90 Mikrometer Durchmesser und sind ein Beispiel für halb künstliche Chloroplasten aus Marburg. Sie enthalten bereits Thylakoidmembranen aus echten Chloroplasten, in denen die Primärreaktion der Fotosynthese abläuft. © T. Erb / MPI für terrestrische Mikrobiologie; CC BY-NC-SA 4.0
Alternativ zum rein künstlichen Fotosynthesesystem forscht das Team auch daran, die Enzyme für den CETCH-Zyklus gentechnisch in lebende Zellen einzubauen. „In E. coli-Bakterien ist uns das bereits zu neunzig Prozent gelungen“, berichtet Tobias Erb. Der nächste Schritt ist der gentechnische Einbau des CETCH-Zyklus in den Stoff-wechsel einzelliger Algen – eine viel größere Herausforderung, da sie weitaus weniger erforscht sind als E. coli und deutlich komplexere Zellstrukturen besitzen. Außerdem ist die Entwicklung synthetischer Algenstämme durch ihre niedrigere Wachstumsrate langwieriger. Gelingt der Einbau, so wären große „Algenfabriken“ denkbar, die CO2 besonders effektiv in Biomasse umwandeln können. Das wäre dann tatsächlich ein Schritt hin zur Bewältigung einer der größten Herausforderungen unserer Zeit: die Reduktion der ständig steigenden Konzentration von atmosphärischem Kohlenstoffdioxid.
Abbildungshinweise:
Titelbild: © S. Peterman / Adobe Stock; MPI für terrestrische Mikrobiologie
Abb. A: © Grafik: A. Bracher / © MPI für Biochemie
Abb. B: © Grafik auf Grundlage von T. Erb; acatech/Leopoldina/Akademienunion (Hrsg.): Künstliche Photosynthese. Forschungsstand, wissenschaftlich-technische Herausforderungen und Perspektiven, München 2018.
Abb. C: © T. Erb, MPI für terrestrische Mikrobiologie / CC-BY-NC-SA 4.0
Abb. D: links © Science History Images / Alamy Stock; rechts © T. Erb, MPI für terrestrische Mikrobiologie / CC-BY-NC-SA 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX 37, Frühjahr 2022; Text: Christina Beck, Roland Wengenmayr; Redaktion: Tanja Fendt



