Techmax 23: Moleküle auf der Zunge
plus Shipping Costs
Wie die Physik das Essen erforscht
Essengehen mit Thomas Vilgis ist ein besonderes Erlebnis. Schnell ist man bei der Frage, wie Mundgefühl, Geschmack und Aromen entstehen. Was passiert beim Kauen? Wie brechen dabei Strukturen aus großen Molekülen auf und setzen Aromen frei? Bei dem Mainzer Physikprofessor und Max-Planck-Forscher lernt man: Die Eigenschaften von Nahrung sind ganz direkt mit der Nanowelt der Moleküle verknüpft. Dabei spielt verblüffend viel Physik mit. Allerdings sind Käse, Nudeln, Schokolade, Gemüse oder Fleisch ziemlich komplexe Materialien. Bei ihrer Erforschung kann die Physik jedoch eine Stärke ausspielen: das geschickte Vereinfachen. Damit kann sie komplexe Nahrungsmittel in verständliche Grundelemente zerlegen.
Moleküle bestimmen den Unterschied zwischen einem zartem und einem zähen Filet, den Schmelz von Schokolade und viele andere physikalische Eigenschaften von Nahrungsmitteln. Darum geht es in Thomas Vilgis‘ Forschungsgebiet „Food Physics“, also der Physik des Essens. Sein Team forscht am Max-Planck-Institut für Polymerforschung in Mainz. Kocht es auch im Labor?
Diese Frage bringt Birgitta Zielbauer zum Lachen. „Leider nicht“, antwortet sie: „Wir gehen wie alle in der Mensa essen.“ Die promovierte Physikerin ist Laborleiterin im Team und Expertin für das Enträtseln molekularer Vorgänge. Dazu setzen Zielbauer und ihre Teamkollegen verschiedenste Labormethoden ein. Mikroskopische Techniken zählen zum Beispiel dazu, die mit Röntgenstrahlen, Elektronen und Neutronen selbst einzelne Moleküle sichtbar machen können. „Fast alle dieser Methoden haben wir im Haus“, schwärmt die Experimentalphysikerin. Allerdings bedarf es einer guten Theorie, um die Resultate der Experimente richtig zu interpretieren.
Schauen wir uns einige Grundbestandteile von Essen an: Unser Körper benötigt zum Beispiel Proteine für das Muskelwachstum, sie liefern zudem Energie. Hinzu kommen reine Energiespeicher-Moleküle, wie die Kohlenhydrate Zucker und Stärke, die Pflanzen durch Photosynthese herstellen. Am meisten verwertbare Energie speichern die Fette. Je nach Zusammensetzung kann ein Gramm Fett einen „Brennwert“ von bis zu 40 Kilojoule erreichen. Der Brennwert beschreibt die Energie, die der Stoffwechsel unseres Körpers aus einem Stoff gewinnen kann. Kohlenhydrate und Proteine kommen pro Gramm auf ungefähr 17 Kilojoule, Alkohol (Ethanol) sogar auf fast 30 Kilojoule.
Weitgehend unverdauliche Ballaststoffe haben nur einen geringen Anteil verwertbarer Energie. Sie geben uns aber im Wortsinne zu beißen. Dazu zählt Cellulose, deren reißfeste Fasern den Pflanzenzellen Halt geben. Eine vergleichbare Funktion in tierischem Gewebe hat Collagen. Es bildet ein sehr stabiles Netzwerk. Solche Riesenmoleküle machen manche rohe Nahrung zäh, schwer kau- und verdaubar. Die geniale Lösung hierfür ist das Garen. Höhere Temperaturen können die zähen Molekülnetzwerke zerlegen, weich und damit besser verdaulich machen. Mit der Entdeckung des Feuers konnten unsere Vorfahren so neue Nahrungsquellen erschließen. Was Garen genau bewirkt, haben die Mainzer an Schweinefilets als Beispiel untersucht.
Zuerst schauen wir uns aber Bitterschokolade an, denn bei ihr bestimmt die Physik ganz direkt den Genuss. Klassische Bitterschokolade besteht aus den drei Zutaten Kakaomasse, Zucker und etwas zusätzliche Kakaobutter und ist ein schön einfaches „Modellsystem“. Für den richtigen Schmelz sorgen Fettkristalle (Abb. A). Denn, so erstaunlich das klingt: Fettmoleküle können sich zu einer dreidimensionalen Ordnung sortieren. So ein Kristall ist wie ein Parkhaus für gleichartige Atome oder Moleküle. Sind sie darin ordentlich „eingeparkt“, dann spart das Platz und senkt die im Kristall gespeicherte Energie. Wärmeenergie steigert jedoch den Bewegungsdrang der Moleküle. Erhitzt man einen Kristall, dann fliegt das „molekulare Parkhaus“ bei einer bestimmten Schmelztemperatur auseinander. Genauso verflüssigen soll sich Schokolade auf der Zunge. „Sie setzt dann auch die wunderbaren Röststoffe aus dem Kakao frei“, schwärmt Vilgis.
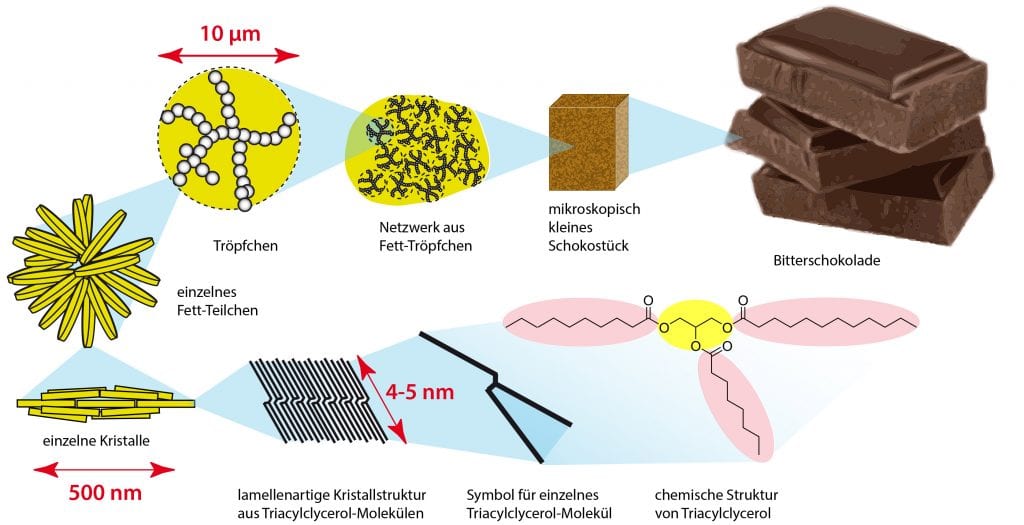
Abb. A: Mit jedem Vergrößerungsschritt (von rechts oben nach rechts unten) wechselt die Struktur des Fetts: Vom Netzwerk aus erstarrten Fett-Tröpfchen über Fett-Teilchen aus scheibchenförmigen Kristallen bis hin zur Kristallstruktur aus einzelnen Triacylglycerol-Molekülen. Die gezeigte Kristallsorte schmilzt bei 33,8 Grad Celsius, zergeht also auf der Zunge. Rechts unten: die chemische Struktur von Triacylglycerol.
© T. Vilgis, R. Wengenmayr / CC BY-NC-SA 4.0
Schokolade zum Schmelzen
Für das gewünschte Schmelzverhalten müssen die Schokoladehersteller ganz bestimmte Fettkristalle wachsen lassen. Deren Schmelztemperatur hängt direkt von den Eigenschaften der Moleküle ab. In natürlichen Fetten und Ölen sind das vor allem Moleküle, die Triacylglycerole genannt werden. In den Triacylglycerolen hängen drei Fettsäuren wie Beinchen an einem zentralen Glycerin. Dabei gibt es verschiedene Triacylglycerol-Sorten mit unterschiedlich langen Fettsäure-Beinchen.
Ketten aus Kohlenstoffatomen bilden das „Rückgrat“ dieser Fettsäuren. Da ein Kohlenstoffatom vier äußere Elektronen hat, sozusagen vier Hände, kann es maximal vier Nachbaratome festhalten. In gesättigten Fettsäuren geht jedes Kohlenstoffatom zu seinem benachbarten Kohlenstoffatom nur eine einfache Bindung ein, an den beiden noch freien Bindungen hängen dann meist je zwei Wasserstoffatome. Hat sich in die Kohlenstoffkette eine chemische Doppelbindung eingeschlichen, bei der sich zwei Kohlenstoffatome an beiden Händen fassen, dann sprechen Chemiker von einer ungesättigten Fettsäure und je nach Anzahl der Doppelbindungen von einer einfach, zweifach und so weiter ungesättigten Fettsäure.
Die Eigenschaften der Fettsäuren bestimmen die Schmelztemperatur der Fettkristalle: Je schwerer die Fettsäuren sind, desto höher ist die Schmelztemperatur des Fettkristalls. Je ungesättigter die Fettsäuren sind, desto mehr wiederum wird die Schmelztemperatur gesenkt. „Denn jede Doppelbindung macht einen Knick ins Fettsäuremolekül“, erklärt Vilgis. „Geknickte Fettsäuren können sich aber nicht mehr so schön zu einem stabilen Kristall sortieren. Deshalb genügen relativ niedrige Temperaturen, um Kristalle aus ungesättigten Fettsäuren zu schmelzen. Olivenöl und andere Speiseöle sind daher bei Zimmertemperatur flüssig.“
Gute Schokolade braucht dagegen eine Sorte Fettkristalle, die bei knapp über 30 Grad Celsius auf der Zunge schmilzt. Kakaomasse ist aber eine komplexe Mischung aus Triacylglycerolen mit verschiedenen Fettsäuren. Diese würden gerne sechs verschiedene Kristalltypen mit unterschiedlicher Schmelztemperatur ausbilden. Deshalb lässt man die geschmolzene Schokomasse ganz langsam auf 28 bis 31 Grad Celsius abkühlen. Das erzwingt vor allem das Wachsen des gewünschten Kristalltyps. Dieser erzwungene Zustand ist allerdings nicht dauerhaft stabil. Altert Schokolade, dann baut sie sich in verschiedenartige Fettkristalle um und bildet an der Oberfläche weißen „Fettreif“. Das ist vor allem ein unerwünschter Kristalltyp mit zu hoher Schmelztemperatur.
Um ihrer feinen Schokolade den richtigen Schmelz zu geben, mischen Chocolatiers oft Kakaobutter aus verschiedenen Gegenden. Für den Kakao gilt wie für jede andere Pflanze: Je weiter nördlich sie wächst, desto ungesättigter sind ihre Fettsäuren. Ursache ist wieder die Temperatur, denn das Fett darf im kälteren Klima nicht auskristallisieren und die Zellen zerstören. Je heißer aber das Klima wird, desto schneller reagieren ungesättigte Fettsäuren mit Sauerstoff: Sie oxidieren, das Fett wird ranzig. Deshalb enthält Kakao vom Äquator mehr gesättigte Fettsäuren – wie Kokosfett. Diese Kakaobutter schmilzt bei etwas höheren Temperaturen.
Besonders viel Fett speichern die Samen von Hülsenfrüchten, Nüssen, Sojabohnen und andere Ölfrüchten. Sie benötigen diesen Energievorrat zum Keimen. „So eine Nuss oder Sojabohne muss aber in der Natur viel aushalten können“, sagt Vilgis. Einmal vom Strauch gefallen, muss sie Hitze, Kälte, Trockenheit überstehen, ohne dass ihr Fettvorrat ranzig wird. Manche Samen bleiben sogar über Jahrhunderte hinweg keimfähig. Das geht nur, wenn ihr Fettspeicher extrem stabil verpackt ist. Dafür sorgen raffiniert aufgebaute Ölkörperchen.
Sojamilch mit Nanopartikeln
Diese Oleosome erforschen die Mainzer Wissenschaftler. Im Fokus stehen Sojabohnen, deren Oleosome mit 360 Nanometern Durchmesser (das sind Milliardstel Meter) besonders klein sind. „Mit Sojamilch trinkt man also Nanopartikel“, scherzt Vilgis. Um Oleosome dauerhaft stabil zu machen, wendet die Natur zwei Tricks an. Trick eins: Sie sorgt für eine Emulsion, in dem sich die feinen Öltröpfchen im wässrigen Zellinneren verteilen und nicht zusammenklumpen. Das ist wichtig, denn nur fein verteilte Oleosome bilden gemeinsam eine große Oberfläche. Darüber kommt der Samen beim Keimen schnell an die gespeicherte Energie heran. Für die Emulsion benötigen Oleosome eine wasserfreundliche Hülle. Dafür sorgen Moleküle, die auch die Membranwände aller lebenden Zellen formen, die Phospholipide. Sie sind starke Emulgatoren. Warum? Phospholipide besitzen ein wasserliebendes (hydrophilen) Köpfchen, an dem zwei fettliebende (lipophile) Molekülbeinchen hängen. Wenn sie die Hülle der Oleosome bilden, dann stecken sie diese Beinchen ins Öltröpfchen, während sie ihre wasserfreundlichen Köpfchen ins wässrige Zellinnere recken (Abb. B).
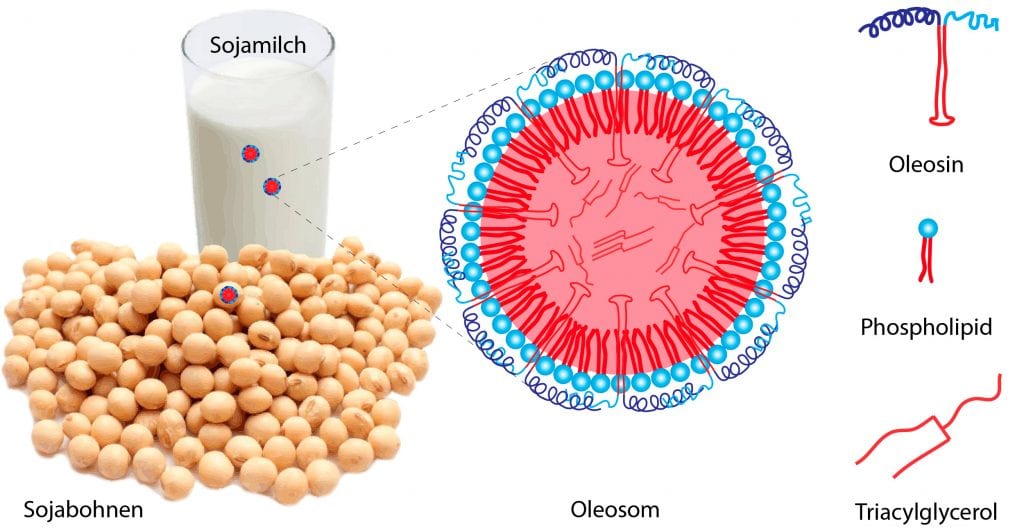
Abb. B: Oleosome sind die Fettkörperchen, in denen Samen ihren Energievorrat viele Jahre lang sicher aufbewahren. In Soja sind diese kugelförmigen Fett-Tröpfchen nur etwa 360 Nanometer (Millardstel Meter) klein. Stabilisiert werden sie von einer neun Nanometer dünnen Hülle. Diese besteht aus Phospholipiden und Proteinen. Als Emulgatoren sorgen Erstere dafür, dass die Oleosome sich im wässrigen Zellinneren fein verteilen. Für die hohe Stabilität sind Oleosin-Moleküle verantwortlich, die wie kleine Regenschirme in den Ölkörperchen stecken.
© T. Vilgis, R. Wengenmayr / CC BY-NC-SA 4.0
„Oleosome sind bis fast hundert Grad Celsius stabil!“, sagt Vilgis. Für diese Stabilität sorgt Trick zwei: besondere Moleküle in der Oleosomhülle, sogenannte Oleosine. Birgitta Zielbauer vergleicht sie mit Regenschirmen. Der „Schirmstiel“ ist aus einer Molekülschlaufe geformt und lipophil, wird also ins Öl gezogen. Der schirmförmige Teil ist dagegen hydrophil und wendet sich zur wässrigen Umgebung der Zelle. Er ist elektrisch geladen, und die gleiche Ladung sorgt dafür, dass benachbarte Oleosome sich gegenseitig abstoßen. Das verhindert ein gefährliches Verklumpen. Die Mainzer konnten zeigen, dass eine nur neun Nanometer dünne Schale genügt, um die Soja-Oleosome so stabil zu machen.
„Das Wechselspiel zwischen hydrophil und lipophil ist ein ganz wesentlicher Ordnungsfaktor in der Biopyhsik und damit in Nahrungsmitteln“, erklärt Vilgis. Viele große Biomoleküle finden ihre biologisch korrekte Struktur, weil einige ihrer Abschnitte gerne Kontakt zum wässrigen Zellinneren haben, andere nicht. Wassermoleküle sind „polar“, das heißt, dass sie Bereiche mit positiver und negativer Ladung haben. Passend dazu besitzen viele Biomoleküle elektrisch geladene Abschnitte, die zum Wasser hingezogen werden. Andere Teile sind „nichtpolar“ und mögen eher ein fettiges Umfeld. Sie suchen im Inneren des Proteins Schutz vor dem wässrigen Zellinneren. Das ist einer der Mechanismen, der Proteine in genau die richtige Form faltet. Nur damit können viele Proteine in der Zelle ihre Aufgaben korrekt ausführen.
Die Form der Proteine bestimmt auch, wie sich Fleisch beim Garen verhält. Das Mainzer Team hat erforscht, was in Schweinefilets beim Vakuumgaren passiert. Dieses „Sous-vide-Garen“ ist derzeit im Trend und wird gerne von Caterern eingesetzt. Dazu schweißt man das Fleischstück in einen luftleer gepumpten Plastikbeutel ein. In diesem gart man es in einem Wasserbad bei niedrigen Temperaturen zwischen 50 und 80 Grad Celsius. Der Vorteil: Das Fleisch wird zart und „saugt“ die Aromen der zugegebenen Gewürze in sich auf. Zudem soll es auch zart bleiben, wenn es länger bei niedriger Gartemperatur gelagert wird. Aber stimmt das?
Das stimmt nicht, fanden die Mainzer heraus. Ihre Forschung zeigte: 20 Minuten Vakuumgaren bei 55 Grad Celsius erzeugt das perfekte Schweinefilet. Längeres Garen macht es zäher. Warum? Die Antwort findet sich vor allem in den Muskelproteinen – und im Collagen, dem Protein des Bindegewebes. Unter Zufuhr von Wärmeenergie verändern Proteine ihre Molekülstruktur. Dieses „Denaturieren“ passiert auch beim Hartkochen von Eiern. Filet ist Muskelfleisch, und darin dominieren zwei Sorten Proteine: Myosin und das faserige Actin. Stellt sich nun die Frage, wie sich diese beiden Proteine beim Garen verhalten.
Essen mit den Sinnen
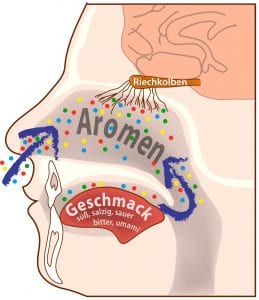
Am Essen sind mehrere Sinne und Nerven beteiligt etwa beim Mundgefühl. Auf der Zunge schmecken wir süß, salzig, sauer, bitter und umami. Umami kommt aus dem Japanischen und heißt so viel wie „herzhaft, fleischig, wohlschmeckend“. Wichtig sind Aromen, also Duftmoleküle (bunte Punkte), die beim Kauen frei werden. Sie steigen von hinten in den Nasenraum zum Geruchssinn auf. Den Duft des Essens atmen wir auch direkt durch die Nasenlöcher ein.
Um das herauszufinden, verwendeten die Mainzer eine Methode, die sehr empfindlich misst, welche Wärmeströme beim Erhitzen in eine Probe fließen. Bleibt deren Temperatur eine Weile stabil, obwohl Wärmeenergie ins Fleisch „verschwindet“, dann heißt das: Diese Energie wandelt gerade Molekülstrukturen um. Auch beim Schmelzen von Wassereis bleibt das Thermometer zunächst bei null Grad hängen.
„Dabei kommen 40 Tausendstel Gramm der Fleischprobe in einen kleinen Alu-Tiegel“, erklärt Zielbauer: „Das verschweißen wir, damit kein Wasser austreten kann.“ Dann messen die Forscher das Temperaturverhalten dieser Probe im Vergleich zu einem leeren Referenztiegel. Sie heizen beide Tiegel mit exakt der gleichen Energiezufuhr auf. Sobald sich Moleküle im Fleisch verändern, steigt die Temperatur in ihm langsamer als im leeren Tiegel. Die Mainzer ließen nun ihre Proben zwischen zehn Minuten und 48 Stunden lang bei Temperaturen zwischen 45 und 74 Grad Celsius garen und beobachteten die Wärmeströme.
Die Kunst des Garens
Es zeigte sich, dass sich das Myosin schon ab 45 Grad Celsius verändert, während das Actin noch seine ursprüngliche molekulare Gestalt beibehält. Das Myosin bildet dann ein lockeres Molekülnetzwerk. Dieses kann in seinen molekularen Zwischenräumen Wasser festhalten. Dadurch bleibt das Fleisch saftig und wird zart. Steigt die Temperatur gegen 70 Grad Celsius, verändert sich das Actin: Die langen Moleküle ziehen sich zusammen und pressen Wasser aus den Muskelfasern heraus. So wird das Fleisch trocken. Collagen wiederum baut sich schon bei etwa 60 Grad um, das Fleisch verliert seine Zähigkeit.
Die Mainzer konnten auch zeigen: Bewahrt man sein schön zartes Filet länger bei Temperaturen oberhalb 45 Grad Celsius auf, dann wird es langsam zäh. Dann verändern allmählich alle für den Genuss wichtigen Proteine ihre natürliche Gestalt. Dieses „Denaturieren“ gilt auch für Proteine, die das eigentlich erst bei höheren Temperaturen tun sollten. „Das Molekül muss sozusagen einen Energieberg überklettern, um vom natürlichen in den denaturierten Zustand zu kommen“, sagt Zielbauer. Wenn man das Filet zum Beispiel auf 71 Grad aufheizt, dann hebt das alle Proteine über ihre jeweiligen Energieberge. Das Fleisch wird schnell trocken und zäh. Bei Temperaturen, die eigentlich zu niedrig zum Überwinden des Energiebergs sind, schafft aber doch ab und zu ein Protein zufällig den Sprung in den denaturierten Zustand.
Hält man also das Stück Fleisch bei niedrigen Temperaturen warm, dann wird es auch langsam zur Schuhsohle. Food Physics kann verblüffend gut erklären, was mit den Molekülen beim Zubereiten und Genuss von Essen passiert. Berühmte Köche wissen das und holen sich gerne Tipps von den Mainzern.
Abbildungshinweise:
Titelbild: Schokolade-Moleküle © Amalia Lopez – Latte Design
Abb. A: Bitterschokolade © T. Vilgis, R. Wengenmayr / CC BY-NC-SA 4.0
Abb. B: Oleosome © T. Vilgis, R. Wengenmayr / CC BY-NC-SA 4.0
Exkurs: Essen-Sinne © Roland Wengenmayr / CC BY-NC-SA 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
TECHMAX Ausgabe 23, Sommer 2016; Redaktion: Christina Beck, Autor: Roland Wengenmayr