Biomax 31: Jederzeit abwehrbereit
plus Shipping Costs
Den Mechanismen unseres Immunsystems auf der Spur
In den Körpern aller Lebewesen tobt ein täglicher Kampf gegen Viren, Bakterien, Pilze und Parasiten, die von außen eindringen. Selbst einfachste Organismen besitzen daher eine vielfältig ausgestaltete Immunabwehr. Die sogenannte angeborene oder natürliche Immunität, die sich schon bei wirbellosen Tieren und selbst bei Pflanzen findet, erlaubt eine besonders rasche, unspezifische, aber trotzdem wirkungsvolle Verteidigung.
Die Struktur der beteiligten Proteine und die dazugehörige Bauanleitung sind im Genom festgelegt und können im Laufe des Lebens eines Individuums nicht an neue Bedingungen angepasst werden. Um diesen Nachteil zu beheben, hat sich im Verlauf der Evolution im angeborenen Immunsystem eine immer größere Zahl verschiedener Zelltypen und löslicher Faktoren herausgebildet. Schon wenige Minuten nach dem Eindringen werden die meisten Erreger erkannt und sind bereits nach Stunden vollständig beseitigt. Die angeborene Immunabwehr ist also weit mehr als nur eine erste Schutzreaktion, in der Regel ist sie allein schon wirksam genug, um den Großteil der Infektionen zuverlässig abzuwehren.
Dennoch verfügen Wirbeltiere, uns Menschen eingeschlossen, noch über eine zweite Verteidigungsinstanz: das adaptive Immunsystem. Es wird aktiv, wenn die natürlichen Abwehrmechanismen alleine dem Angreifer nicht gewachsen sind. Evolutionär gesehen ist dieser „Zweitschutz“ relativ neu: Erst vor ca. 500 Millionen Jahren begannen Wirbeltiere, zusätzlich zum „natürlichen“ auch ein „adaptives“ Immunsystem zu entwickeln. Die adaptive Immunabwehr hat – wie schon der Name sagt – einen entscheidenden Vorteil: Sie ist lern- und anpassungsfähig. Sie reagiert selektiv auf Infektionen und kann bereits bekannte Erreger mit gesteigerter Effizienz bekämpfen. Wer eine Masern-Infektion überwunden hat, ist daher ein Leben lang zumindest vor diesem Virus geschützt. Dieses Prinzip machen sich Ärzte seit über 200 Jahren gezielt bei Impfungen zu Nutze.
„Man darf sich diese Varianten der Immunabwehr jedoch nicht als unabhängig oder voneinander getrennt vorstellen“, betont Thomas Boehm, „mit der sofortigen Reaktion gegen Erreger durch das angeborene Immunsystem geht auch eine Aktivierung der adaptiven Immunantwort einher. Beide gemeinsam eliminieren dann den Krankheitserreger.“ Der Direktor am Max-Planck-Institut für Immunbiologie und Epigenetik forscht schon seit Langem an den genetischen Grundlagen des Immunsystems. Das langfristige Ziel des Freiburger Wissenschaftlers ist die Entwicklung zielgerichteter Therapien, die fehlerhafte Immunfunktionen beim Menschen korrigieren sollen.
Unterscheidung von „selbst“ und „fremd“
Eine der grundlegenden Eigenschaften der angeborenen wie der adaptiven Immunabwehr ist die Fähigkeit, zielgenau zwischen „fremd“ und „selbst“ zu unterscheiden. Denn bekämpft das Immunsystem irrtümlicherweise körpereigenes Gewebe, so kommt es zu schweren Entzündungsreaktionen und in der Folge zu Schäden an den betroffenen Organen. Während sich die Fähigkeit der Fremd-/Selbst-Unterscheidung im angeborenen Immunsystem über Jahrmillionen der Evolution hinweg entwickelt hat, muss diese Fähigkeit bei der adaptiven Immunantwort in jedem einzelnen Individuum neu erworben werden. „Wie fehleranfällig die Ausbildung dieser Selbsttoleranz ist, zeigen die vielen Patienten, die unter Autoimmunerkrankungen wie Diabetes, Rheuma, Multiple Sklerose etc. leiden“, erklärt Boehm. Trotz intensiver Forschung sind die genauen Ursachen solcher Autoimmunerkrankungen nach wie vor unklar.
Boehm interessiert sich daher besonders für ein Organ: die Thymusdrüse (Abb. A). Der Thymus ist ein kleines, aber sehr wichtiges Organ unseres Immunsystems, denn nur er liefert die Umgebung für die Entwicklung und Reifung einer bestimmten Sorte weißer Blutkörperchen, der sogenannten T-Lymphozyten oder einfach T-Zellen (das „T“ leitet sich dabei von ihrem Herkunftsort, dem Thymus ab). Dieser Prozess vollzieht sich unter dem Einfluss eines ganz bestimmten regulatorischen Proteins, des Transkriptionsfaktors Foxn1. Er koordiniert in den Epithelzellen des Thymus die Aktivität einer großen Anzahl von Genen, die nicht nur für die Anlockung der Vorläuferzellen zum Thymus, sondern auch für die Steuerung der nachfolgenden Differenzierung in reife T-Zellen verantwortlich sind.
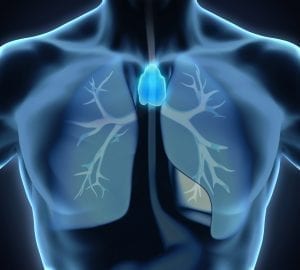
Abb. A: Der Thymus ist ein unscheinbares hinter dem Brustbein gelegenes Organ. Erst seit etwa 50 Jahren ist bekannt, dass dieses Organ für die Funktion des Immunsystems unverzichtbar ist. Es sorgt für die Ausbildung der so genannten T-Zellen, die Virus-infizierte Zellen und Tumorzellen aufspüren und vernichten und den sogenannten B-Zellen bei der Antikörperbildung helfen.
© Shutterstock
Und damit sind wir schon mittendrin in der adaptiven Immunabwehr. T-Zellen sind nämlich der eine Arm der adaptiven Immunabwehr; der andere sind die Antikörper-produzierenden B-Zellen (sie entstehen, wie auch die T-Vorläuferzellen, im Knochenmark). Antikörper erkennen intakte Antigene, also Proteine, die von eingedrungenen Erregern stammen, und heften sich daran. Dadurch werden die Erreger (zum Beispiel Bakterien oder Viren) entweder direkt neutralisiert oder für andere Abwehreinheiten als zu zerstörendes Ziel markiert. Es gibt Abermilliarden unterschiedlicher Antikörper, jeder mit einer anderen Bindungsstelle für ein ganz spezifisches Antigen.
T-Zellen hingegen reagieren erst, wenn ihnen andere Körperzellen (Makrophagen, dendritische Zellen oder B-Zellen) Bruchstücke von Erregerproteinen (Peptide) auf einem „molekularen Präsentierteller“ gewissermaßen zur Überprüfung anreichen. Zu diesem Zweck sind die T-Zellen mit einer eigenen Klasse von Molekülen ausgestattet, den T-Zell-Rezeptoren. Bei dem „molekularen Präsentierteller“ handelt es sich um die sogenannten MHC-Proteine, deren Bauanleitung in den Genen des sogenannten Haupthistokompatibilitätskomplexes (engl. major histocompatibility complex) abgelegt ist. Jedes MHC-Protein kann eine große und gleichzeitig charakteristische Auswahl unterschiedlicher Proteinbruchstücke (Peptide) binden, die durch Proteinabbau innerhalb der oben genannten Körperzellen entstehen. Der Peptid-MHC-Protein-Komplex wird an der Zelloberfläche präsentiert; Komplexe, die ein körperfremdes, das heißt beispielsweise ein virales Peptid enthalten, werden von den T-Zell-Rezeptoren erkannt. Die infizierten Zellen werden dann entweder direkt oder durch Stimulation anderer Abwehrzellen abgetötet.
T-Zell-Training im Thymus
Praktisch jede unserer Millionen von T-Zellen bekommt im Thymus per Zufallsprinzip einen anderen T-Zell-Rezeptor zugeteilt, so dass das Immunsystem fast jeden Krankheitserreger erkennen kann. Die entscheidende Frage ist aber: Wie entstehen T-Zellen, die zuverlässig „selbst“ und „fremd“ voneinander unterscheiden können? „Dem Thymus kommt hierbei eine ganz entscheidende Rolle zu – er ist eine Art ‚T-Zell-Schule‘“, erklärt Boehm: „Die T-Zellen werden im Thymus „trainiert“, an die eigenen MHC-Moleküle anzudocken und dabei körpereigene Strukturen zu tolerieren.“ Und wie funktioniert das genau?
In einem ersten Schritt, der sogenannten positiven Selektion im Thymus überleben nur diejenigen T-Zellen, die MHC-Moleküle auf den körpereigenen Zellmembranen erkennen können; T-Zellen, die körpereigene MHC-Moleküle gar nicht binden (also erkennen) können, werden als untüchtig eliminiert (Abb. B).
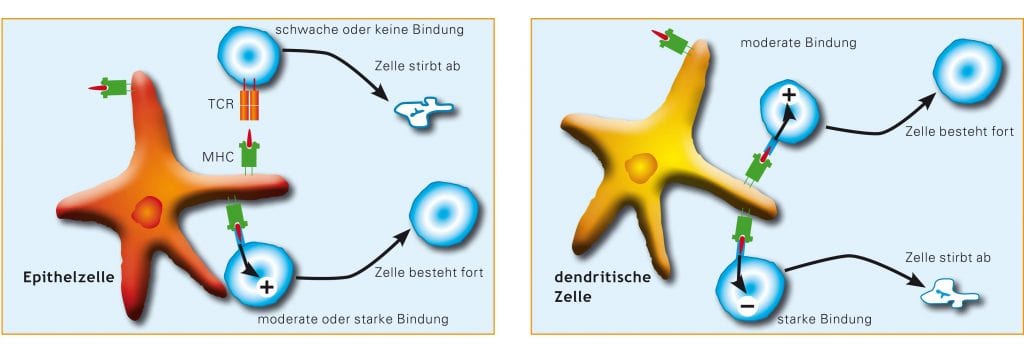
Abb. B: Das T-Zell-Rezeptor-Repertoire bildet sich durch die Kombination von positiver und negativer Selektion, die während der T-Zell-Entwicklung im Thymus ablaufen. Diese Selektionsvorgänge sorgen dafür, dass T-Zellen mit möglicherweise nützlichen Rezeptoren überleben und heranreifen und die anderen T-Zellen absterben. In einem ersten Schritt (links) werden T-Zellen, deren Rezeptoren an körpereigene MHC-Proteine binden können ausgelesen, während T-Zellen, die gar nicht oder nur schwach an körpereigene MHC-Proteine binden, aussortiert werden. T-Zellen, die stark mit an körpereigene MHC-Proteine gebundenen Eigen-Peptiden reagieren, werden dann in einem zweiten Schritt aktiv eliminiert (rechts).
© The Immune System, Garland Science 2009
Es reicht aber nicht, dass der Thymus T-Zellen mit einer Erkennungsfähigkeit für körpereigene MHC-Proteine selektioniert – er muss vielmehr gleichzeitig gegen T-Zellen auslesen, die zu stark mit körpereigenen Proteinbruchstücken auf den MHC-Proteinen reagieren. Dieser zweite Schritt wird als negative Selektion bezeichnet. Auf bislang nur teilweise verstandene Weise gelingt es, im Thymus das gesamte Spektrum der im Körper gebildeten Proteine für die Testung der T-Zell-Rezeptoren vorzuhalten. Nur so ist es möglich, aus den in großer Anzahl heranreifenden T-Zellen diejenigen herauszufischen, die später durch Erkennung körpereigener Gewebe zu Autoimmunkrankheiten führen könnten. Im Thymus werden also letztendlich nur solche T-Zellen produziert, die zwar MHC-Proteine erkennen können, aber die Anwesenheit körpereigener Peptide in diesen MHC-Komplexen weitgehend ignorieren. Die übrigbleibenden T-Zellen reagieren besonders empfindlich auf Fremdpeptide.
Boehm und seine Mitarbeiter möchten die Mechanismen besser verstehen lernen, die bei der „T-Zell-Schulung“ eine wirksame Qualitätskontrolle sicherstellen. „Diese Kontrolle ist notwendig, um Zellen mit potenziell selbstreaktiven Antigen-Rezeptoren in Schach zu halten und/oder zu zerstören“, so Boehm. Und könnte für das bessere Verständnis der Entstehung von Autoimmunerkrankungen von Bedeutung sein. Das Problem dabei: „Vom Hai bis zum Menschen ist das Immunsystem ähnlich komplex – da sehen wir den Wald vor lauter Bäumen nicht mehr“, erklärt der Immunbiologe. In Freiburg arbeitet er daher nicht nur mit Knochenfischen, wie dem Zebrabärbling, und Säugetieren, wie Mäusen, sondern auch mit Neunaugen (Abb. C) – jenen Ur-Wirbeltieren, die vor rund 500 Millionen Jahren entstanden sind und sich parallel zu den besser bekannten kiefertragenden Wirbeltieren entwickelt haben, zu denen auch der Mensch gehört. Auch Neunaugen sind mit einem adaptiven Immunsystem ausgestattet, das nicht nur über Lymphozyten-ähnliche Zellen verfügt, sondern auch organisierte lymphatische Organe besitzt. Dabei waren die meisten Immun- und Evolutionsbiologen lange Zeit davon überzeugt, dass das adaptive Immunsystem nur bei den höher entwickelten Wirbeltieren existiert – die an der Immunabwehr beteiligten T-Zell-Rezeptoren oder Immunglobuline (Antikörper) konnten bei den Neunaugen und seinen Verwandten einfach nicht nachgewiesen werden.
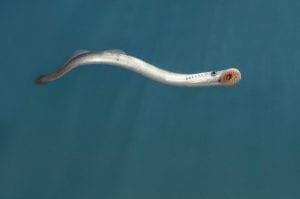
Abb. C: Urtümliches Wirbeltier mit ausgeklügelter Immunabwehr: das Neunauge. Diese kiementragenden, fischähnlichen Wirbeltiere gehören zu den sogenannten Rundmäulern (Cyclostomata), die sich vor etwa 500 Millionen Jahren aus einem letzten gemein-samen Vorfahren aller Wirbeltiere entwickelt haben. Der Name „Neunauge“ geht auf eine falsche historische Beschreibung zurück, wonach der Beobachter neben dem eigentlichen Auge auch die (unpaare) Nasenöffnung und die sieben seitlichen Kiemenspalten als Augen ansah (also neun „Augen“ auf jeder der beiden Körperseiten).
© mauritius images / Minden Pictures
Variabilität durch einen genetischen Kniff
Bis 2004: Da gelang es Max D. Cooper und seinem Team von der US-amerikanischen University of Alabama in Birmingham endlich, dieses Rätsel zu lösen. Das Immunsystem des Neunauges bedient sich nämlich schlichtweg anderer Moleküle, die variable Lymphozyten-Rezeptoren (VLR) genannt werden. Interessanterweise scheinen diese in mehreren Formen zu existieren. Die zwei Arten T-Zell-ähnlicher Lymphozyten bilden Rezeptoren der Typen A oder C auf ihrer Oberfläche aus, während B-Zell-ähnliche Lymphozyten Rezeptoren vom Typ B herstellen. Die Antigen-Rezeptoren sind dabei ähnlich variabel wie bei den höheren Wirbeltieren. Praktisch jeder der untersuchten Lymphozyten des Neunauges hatte einen anders zusammengesetzten Rezeptor. Deren Vielfalt entsteht durch einen vergleichbaren genetischen Kniff: Während der Lymphozyten-Entwicklung werden einzelne Abschnitte des Genoms einfach neu geordnet, und zwar insbesondere jene Regionen der Rezeptor-Gene, die für die Antigen-Bindungsstellen kodieren. Offensichtlich haben also alle Wirbeltiere für ihre Lymphozyten das gleiche Funktionsprinzip gewählt.
Exkurs: T-Zell-Wanderung
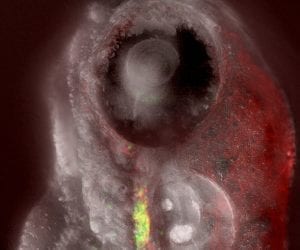
© Isabel Hess/Immunity, 16. Februar 2012T-Zell-Wanderung
T-Zellen sind die Schutztruppen des Immunsystems. Sie suchen im Körper nach Krankheitserregern und entarteten Zellen und setzen sie außer Gefecht. Ihre Vorläufer bilden sich im Knochenmark und wandern von dort aus in den Thymus ein. Das Team um Thomas Boehm konnte diese Vorgänge – angefangen von der Bildung der Thymus-Anlage über das Einwandern der Zellen aus dem Knochenmark bis hin zu dem Stadium, an dem die fertigen T-Zellen aus dem Thymus entlassen werden – in dem durchscheinenden Gewebe von Zebrafisch-Embryonen live beobachten (oben im Bild ist das Auge des vier Tage alten Zebrafisch-Embryos zu sehen). Dazu markierten die Forscher die Epithelzellen des Thymus über ein durch Foxn1 gesteuertes Fluoreszenzprotein rot und die Immunzellen durch ein anderes Fluoreszenzprotein grün. Zebrafisch-Mutanten mit einer Fehlfunktion des Herzens lieferten den Forschern den Beweis, dass die Vorläuferzellen nicht einfach dem Blutstrom fol-gen, wenn sie in den Thymus einwandern, sondern von chemischen Lockstoffen, sogenannten Chemokinen dorthin gelenkt werden.
Siehe auch Video unter: http://www.mpg.de/5036603
Gemeinsamkeiten sind von Bedeutung
Mit der Entdeckung von Lymphozyten mit variablen Antigen-Rezeptoren flammte auch die Frage wieder auf, ob es vielleicht sogar ein Thymus-ähnliches Gewebe bei primitiven Wirbeltieren wie dem Neunauge geben könnte? Trotz jahrzehntelanger Bemühungen hatte man ein solches bei Neunaugen nicht nachweisen können. Boehm und sein Team machten sich nun mit genetischen Methoden auf die Suche. In Thymus-ähnlichen Strukturen sollten ganz spezifische Gene exprimiert, d.h. abgelesen und in Proteine übersetzt werden, u.a. das schon erwähnte Foxn1 sowie jene Gene, die an der Produktion der variablen Lymphozyten-Rezeptoren der Typen A und C beteiligt sind. Und tatsächlich: Im Bereich der Kiemen wurden die Forscher fündig. Sie entdeckten dort Thymus-ähnliche Strukturen, die sogenannten Thymoide. „Es scheint also, dass schon das Neunauge über ein duales System der Immunabwehr verfügt, das wir auch vom Menschen her kennen“, sagt Boehm. Während die T-Zell-ähnlichen Lymphozyten im Thymoid heranreifen, entwickeln sich die B-Zell-ähnlichen Lymphozyten in einer dem Knochenmark funktionell entsprechenden Struktur.
Die Entdeckung eines Thymus-ähnlichen Gewebes beim Neunauge ist der vorläufige Schlusspunkt einer über hundertjährigen Forschungsanstrengung und belegt, dass tatsächlich alle Wirbeltiere Thymus-ähnliche Gewebe besitzen. Das Neunauge hat vor 500 Millionen Jahren parallel zu den höheren Wirbeltieren ein andersartiges, aber ähnlich funktionstüchtiges Abwehrsystem entwickelt. „Wir haben nun ganz unerwartet die Möglichkeit bekommen, die Struktur und das Design eines anpassungsfähigen Immunsystems durch Vergleichsstudien besser zu verstehen“, erklärt Boehm. Die Gemeinsamkeiten zwischen den beiden Systemen sollten zu den unverzichtbaren Grundprinzipien eines adaptiven Immunsystems gehören. Ihre Aufdeckung erlaubt es, die Entwicklung künstlicher immunstimulierender Gewebe in Angriff zu nehmen. „Das sind erste Schritte in Richtung einer klinischen Anwendung“, betont Boehm. Sollte es beispielsweise eines Tages gelingen, dem Thymus nachempfundene künstliche Gewebe zu schaffen, so könnten diese beispielsweise helfen, eine im Alter oder nach Behandlung von Tumorerkrankungen häufig auftretende Immundefizienz zu mildern. „Dazu ist es nötig, die Funktionen, die das Thymusgewebe auszeichnen, auf deren präzise molekulare Grundlagen zurückführen zu können, um sie dann schrittweise und von Grund auf neu aufzubauen“, so der Max-Planck-Forscher.
Abbildungshinweise:
Titelbild; Symbolbild Immunsystem © Shutterstock
Abb A: Thymus © Shutterstock
Abb B: T-Zell-Selektion © The Immune System, Garland Science 2009
Abb C: Neunauge © mauritius images / Minden Pictures
Kasten S. 4: Live-Schaltung in den Thymus © sabel Hess/Immunity, 16. Februar 2012
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 31, Herbst 2015; Autorin: Christina Beck; Redaktion: Tanja Fendt