Menschliche Eizellen bilden oft Spindeln mit mehreren Polen (blaue Kreise). Wird zusätzliches KIFC1 in die Eizelle eingebracht, verbessert es die Stabilität der bipolaren Spindel, indem es deren Mikrotubuli (blau) vernetzt. Die homologen Chromosomen (magenta) werden korrekt getrennt.
© Grafik: HNBM / CC BY-NC-SA 4.0
Reifeteilung I: Während der Reifeteilung I kann es zu einer fehlerhaften Trennung kommen, bei der die homologen Chromosomen falsch verteilt werden (Ia). Es kann auch ein einzelnes Chromatid falsch zugeordnet werden (Ib) oder beide Schwesterchromatiden verteilen sich umgekehrt (Ic). Durch diese inverse Verteilung besitzt die Eizelle zwar die richtige Chromosomenzahl, doch die Chromatiden stammen von verschiedenen homologen Chromosomen und sind nicht mehr durch Kohäsin verbunden, was die Ausrichtung und Trennung in der Reife teilung II beeinträchtigen kann.
Reifeteilung II: In der Reifeteilung II kann es zu einer fehlerhaften Trennung kommen, bei der beide Schwesterchromatiden entweder in der Zygote verbleiben (IIa) oder im zweiten Polkörper entsorgt werden (IIb).
© MPI für Multidisziplinäre Naturwissenschaften / Grafik: HNBM, CC BY-NC-SA 4.0
Verschiedene physiologische Faktoren können zur Unfruchtbarkeit beitragen und betreffen die Frau, den Mann oder beide Partner. Die prozentualen Anteile unterscheiden sich je nach Studie und untersuchten Kriterien. Die Angaben in der Abbildung stellen ungefähre Werte dar.
© Zahlen nach Forti, G. (1998), doi: 10.1210/jcem.83.12.5296 // Grafik: HNBM, CC BY-NC-SA 4.0
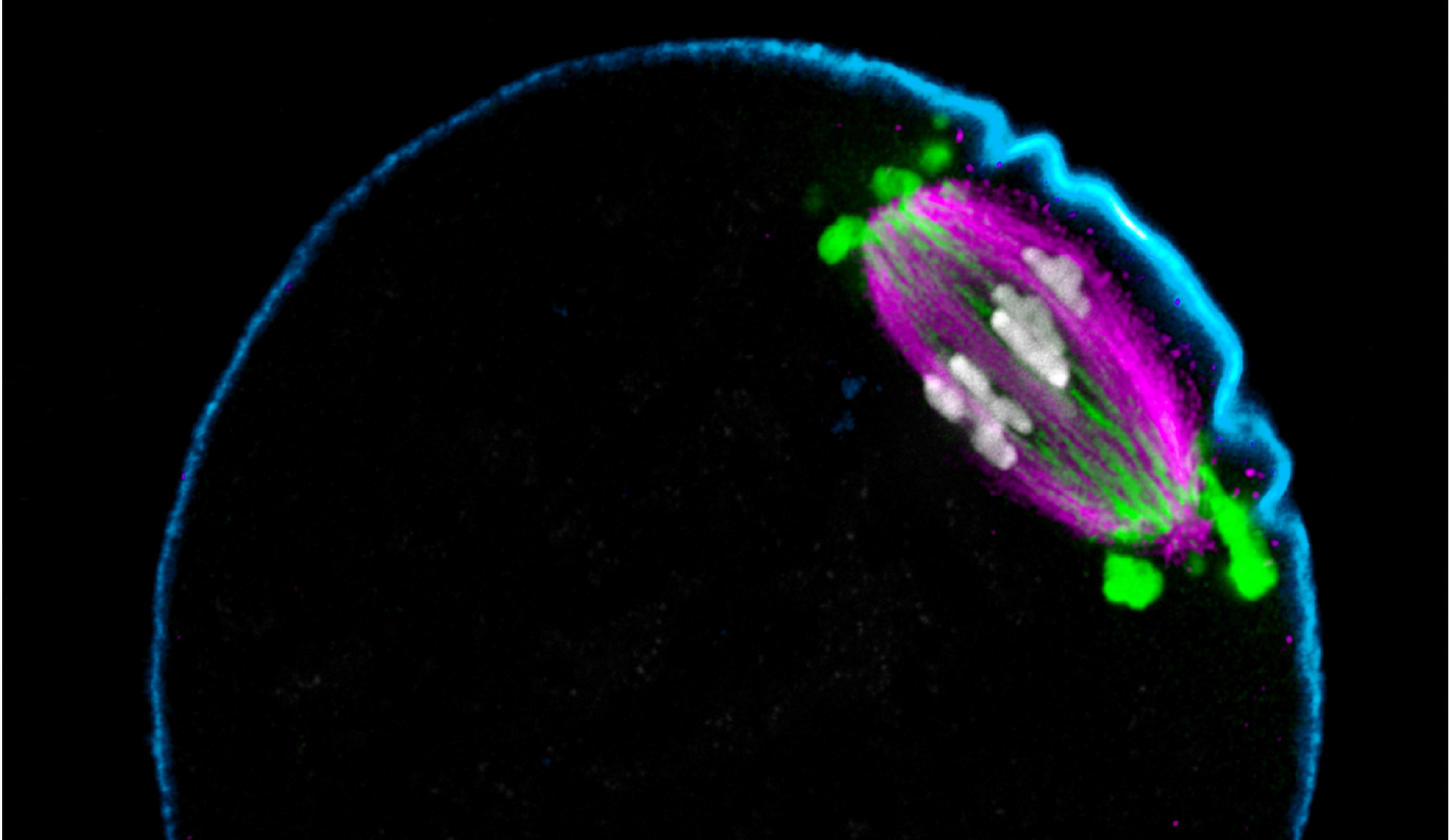
© Chun So / MPI für Multidisziplinäre Naturwissenschaften
Laut einer 2023 veröffentlichten Studie der Weltgesundheitsorganisation ist jeder sechste Mensch im gebärfähigen Alter zumindest zeitweise unfruchtbar. Global sind 17,5 Prozent aller Männer und Frauen demnach an einem Punkt in ihrem Leben davon betroffen, kein Kind zeugen zu können. Ausgewählt und ausgewertet wurden dazu 133 aus weltweit mehr als 12.000 Studien, die zwischen 1990 und 2021 entstanden sind.
In Deutschland ist fast jedes zehnte Paar zwischen 25 und 59 Jahren ungewollt kinderlos. Die Gründe dafür sind vielfältig und – das ist wichtig zu wissen – betreffen beide Geschlechter. Tatsächlich sind die medizinischen Ursachen für Unfruchtbarkeit bei Männern und Frauen gleichverteilt (Abb. A). Die Hauptursache für ungewollte Kinderlosigkeit liegt hierzulande vor allem darin, dass die Menschen sich immer später für eine Elternschaft entscheiden. Das betrifft Männer wie Frauen gleichermaßen. Das Alter der Erstgebärenden ist in den vergangenen Jahrzehnten stetig gestiegen, ebenso wie das der Väter.
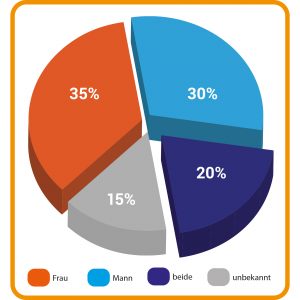
Abb. A: Verteilung der Unfruchtbarkeit: Verschiedene physiologische Faktoren können zur Unfruchtbarkeit beitragen und betreffen die Frau, den Mann oder beide Partner. Die prozentualen Anteile unterscheiden sich je nach Studie und untersuchten Kriterien. Die Angaben in der Abbildung stellen ungefähre Werte dar.
© Zahlen nach Forti, G. (1998), doi: 10.1210/jcem.83.12.5296 // Grafik: HNBM CC BY-NC-SA 4.0
So waren einer Studie des Max-Planck-Instituts für demografische Forschung in Rostock zufolge schon 2013 sechs Prozent aller Neuväter in Deutschland 45 Jahre oder älter und damit fast drei Mal so viele wie noch 1995. Es ist zwar richtig, dass Männer im Durchschnitt deutlich länger fruchtbar sind als Frauen. Etwa ab 40 bis 50 Jahren verschlechtert sich jedoch die Funktion der Spermien, weil sich genetische Defekte in den Samenzellen häufen. Wenn es insgesamt mehr Spermien mit Chromosomenstörungen gibt, dann dauert es länger, bis die Frau schwanger wird. Und abgesehen vom Alter gibt es weitere Faktoren, die die Zeugungsfähigkeit von Männern einschränken können – medizinische ebenso wie durch den Lebensstil implizierte wie Alkohol, Rauchen oder Übergewicht.
Bei Frauen enden die fruchtbaren Jahre deutlich früher. Im Alter zwischen 20 und 24 Jahren haben sie ihre höchste Fruchtbarkeit. Je älter Frauen werden, desto mehr sinkt jedoch die Wahrscheinlichkeit, schwanger zu werden, während die Wahrscheinlichkeit einer Unfruchtbarkeit ansteigt (Abb. B). Und das hängt ganz maßgeblich mit den Eizellen zusammen. So wird eine Frau bereits mit ihrer gesamten Reserve an Eizellen geboren. Im Laufe des Lebens entstehen keine neuen Eizellen mehr. Bei Geburt sind rund eine Million unreife Eizellen (Oozyten) angelegt. Die meisten sterben ab – zu Beginn der Pubertät sind noch etwa 300.000 übrig. Ihre Zahl nimmt dann weiter kontinuierlich ab. Bei einer von 100 Frauen ist die Eizellreserve bereits vor dem 40. Lebensjahr komplett erschöpft. Auch die Qualität der Eizellen sinkt ab dem 35. Lebensjahr deutlich. So steigt der Anteil jener Eizellen, die eine von der Norm abweichende Anzahl an Chromosomen aufweisen (man bezeichnet diese Eizellen als aneuploid). Bei Frauen ab 35 Jahren treten bei mehr als 50 Prozent der Eizellen Aneuploidien auf. Man spricht hier vom „maternal age effect“ (mütterlicher Alterseffekt).
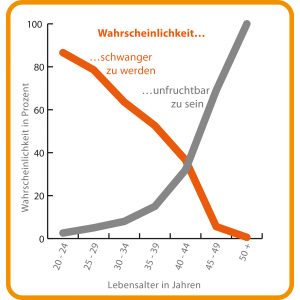
Abb. B: Die biologische Uhr tickt
© Quellen: Carcio, H. A.: Management of the Infertile Woman; Rosenthal, M. S.: The Fertility Sourcebook (1998) // Grafik: HNBM
Am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften in Göttingen erforscht das Team um Melina Schuh die Entwicklung von Eizellen – und was dabei alles schief gehen kann. Denn tatsächlich sind bereits bei jungen Frauen im Alter von 20 bis Anfang 30 mehr als 20 Prozent der Eizellen aneuploid. „Im Gegensatz dazu sind nur ein bis zwei Prozent der Spermien und weniger als ein Prozent der meisten somatischen Zelltypen aneuploid“, erklärt Schuh. Wenn diese fehlerhaften Eizellen befruchtet werden, dann führt das typischerweise zu Fehlgeburten oder auch zu Unfruchtbarkeit. Statistisch führt nur jede dritte Befruchtung bei Frauen zu einer erfolgreichen Schwangerschaft.
Eine reife Eizelle entwickelt sich aus einer Oozyte, die noch jeweils zwei Kopien von jedem Chromosom besitzt, also diploid ist. Um ein befruchtungsfähiges Ei zu werden, muss sie daher die Hälfte ihrer 46 Chromosomen ausschleusen. Dies geschieht einmal pro Menstruationszyklus in einer spezialisierten Zellteilung, der Reifeteilung I. Dabei werden die homologen Chromosomen der Oozyten mithilfe einer komplexen Maschinerie – dem Spindelapparat – getrennt. Er besteht aus Spindelfasern, die sich während der Meiose an die Chromosomen anheften. Die Fasern ziehen dann jeweils eines der homologen Chromosomen zu den gegenüberliegenden Polen der Spindel. Die Oozyte teilt sich dazwischen in eine große, nun haploide Eizelle und eine deutlich kleinere „Abfallzelle“, den sog. Polkörper.
„Genau das klappt jedoch oftmals nicht zuverlässig, sodass eine Eizelle mit falscher Chromosomenzahl entsteht“, erklärt Melina Schuh. Das Max-Planck-Forschungsteam will daher verstehen, wie die Zelle die Chromosomen vorbereitet, um sie in den Polkörper zu entsorgen, und wie die Maschinerie im Detail funktioniert, die die Chromosomen zwischen Eizelle und Polkörper verteilt. Die große Herausforderung dabei: Bei Säugetieren entwickeln sich die Oozyten im Inneren des Körpers. Um diesen Vorgang überhaupt untersuchen zu können, musste Schuh einen Weg finden, die Zellen außerhalb des Körpers zu kultivieren, und zwar so, dass sie diese über viele Stunden hinweg unter einem hochauflösenden Mikroskop untersuchen kann – eine Pionierleistung, die ihr schon während ihrer Promotion gelang.
„Was wir bereits wussten ist, dass menschliche Eizellen häufig Spindeln mit instabilen Polen bilden. Solche labilen Spindeln ordnen die Chromosomen bei der Zellteilung falsch an oder bringen sie durcheinander“, berichtet Schuh. Damit sind menschliche Oozyten im Tierreich eher eine Ausnahme. „Die Spindeln anderer Säugetier-Oozyten waren in unseren Experimenten sehr stabil“, so die Max-Planck-Direktorin. Um herauszufinden, was menschliche Spindeln derart labil macht, verglich das Team das molekulare Inventar an Proteinen, das für die Spindelstabilität erforderlich ist, in verschiedenen Säugetier-Oozyten. Für diese Versuche nutzten die Forschenden auch unbefruchtete unreife menschliche Eizellen, die nicht für die Kinderwunschbehandlung verwendet werden konnten und von den Patientinnen gespendet wurden. Ein Motorprotein (Motorproteine erzeugen Bewegungen innerhalb der Zelle) mit dem Namen KIFC1 weckte besondere Aufmerksamkeit: Es baut Brücken zwischen den Spindelfasern, hilft so, die Fasern richtig auszurichten, und verhindert, dass sie auseinanderfallen. Interessanterweise enthalten Oozyten von Mäusen und Rindern im Vergleich zu menschlichen Oozyten deutlich mehr von diesem Protein. Beeinflusst die Menge des Proteins somit möglicherweise die Stabilität der Spindeln?
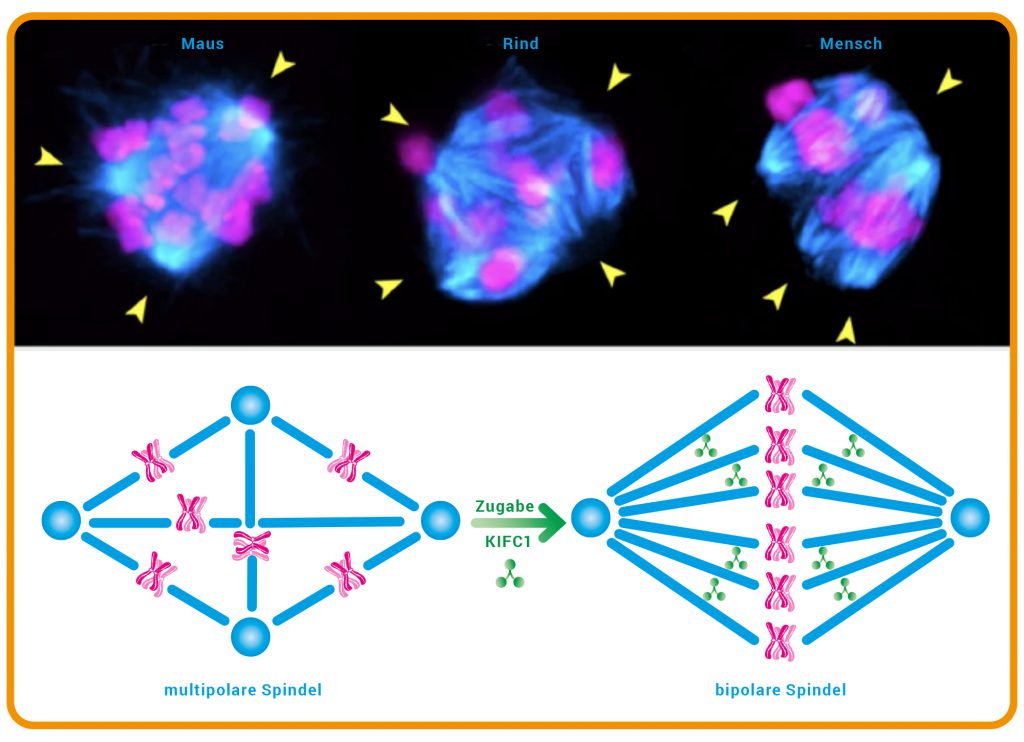
Abb. C: Instabile Spindeln.
Oben: Entfernt man den molekularen Motor KIFC1 aus Mäuse- und Rinder-Oozyten, entstehen multipolare Spindeln und Fehler bei der Chromosomentrennung, wie sie auch bei menschlichen Oozyten mit instabilen Spindeln beobachtbar sind. Die gelben Pfeile weisen auf die instabilen Spindelpole.
Unten: Menschliche Eizellen bilden oft Spindeln mit mehreren Polen (blaue Kreise). Wird zusätzliches KIFC1 in die Eizelle eingebracht, verbessert es die Stabilität der bipolaren Spindel, indem es deren Mikrotubuli (blau) vernetzt. Die homologen Chromosomen (magenta) werden korrekt getrennt.
© Foto: Chun So / MPI für Multidisziplinäre Naturwissenschaften; Grafik: HNBM / CC BY NC-SA 4.0
Um das herauszufinden, entfernten die Forschenden KIFC1 aus den Oozyten von Mäusen und Rindern. Das Ergebnis: Ohne das Protein bildeten auch Mäuse- und Rinder-Oozyten instabile Spindeln und es kam zu mehr Fehlern bei der Chromosomentrennung (Abb. C). „Unsere Versuche legen tatsächlich nahe, dass KIFC1 entscheidend dazu beiträgt, Chromosomen bei der Meiose fehlerfrei zu verteilen“, erklärt Schuh. Könnte das Protein daher ein Ansatzpunkt sein, um Fehler bei der Chromosomentrennung in menschlichen Eizellen zu reduzieren? „Für uns war die spannende Frage, ob die Spindel stabiler wird, wenn wir zusätzliches KIFC1 in menschliche Oozyten einbringen“, erklärt Schuh. Unter dem Mikroskop waren in den Zellen, die zusätzliche Mengen des Motorproteins enthielten, die Spindeln deutlich intakter und es traten weniger Fehler beim Trennen der Chromosomen auf. „Das Einbringen von KIFC1 in menschliche Oozyten ist somit ein möglicher Ansatz, um Fehler in Eizellen zu reduzieren“, hofft die Max-Planck-Forscherin.
Aber das ist nicht der einzige Entwicklungsschritt, der fehlerbehaftet ist (siehe Kasten). Das Göttinger Team hat sich insbesondere gefragt, warum das Risiko, aneuploide Eizellen zu erzeugen, für Frauen in fortgeschrittenem Alter deutlich höher ist und dabei das sogenannte Zygoten-Stadium in den Blick genommen, also die Phase direkt nach der Vereinigung von Spermium und Eizelle. Während nämlich in der Reifeteilung I die homologen Chromosomen auf Eizelle und Polkörper verteilt werden, werden in der Reifeteilung II nach der Befruchtung die Schwesterchromatiden eines jeden homologen Chromosoms voneinander getrennt und auf die Zygote und einen zweiten Polkörper verteilt.
Was alles bei der Verteilung schief gehen kann
Reifeteilung I: Während der Reifeteilung I kann es zu einer fehlerhaften Trennung kommen, bei der die homologen Chromosomen falsch verteilt werden (Ia). Es kann auch ein einzelnes Chromatid falsch zugeordnet werden (Ib) oder beide Schwesterchromatiden verteilen sich umgekehrt (Ic). Durch diese inverse Verteilung besitzt die Eizelle zwar die richtige Chromosomenzahl, doch die Chromatiden stammen von verschiedenen homologen Chromosomen und sind nicht mehr durch Kohäsin verbunden, was die Ausrichtung und Trennung in der Reife teilung II beeinträchtigen kann.
Reifeteilung II: In der Reifeteilung II kann es zu einer fehlerhaften Trennung kommen, bei der beide Schwesterchromatiden entweder in der Zygote verbleiben (IIa) oder im zweiten Polkörper entsorgt werden (IIb).
© MPI für Multidisziplinäre Naturwissenschaften / Grafik: HNBM / CC BY-NC-SA 4.0
Ringförmige Proteinstrukturen, sogenannte Kohäsin-Komplexe, halten die Schwesterchromatiden zusammen. Sie werden im weiblichen Embryo sehr früh während der DNA-Verdopplung installiert. Studien an Maus-Oozyten zeigen, dass Kohäsin-Komplexe später im Leben nicht mehr neu installiert werden können. „Wenn dies auch für menschliche Oozyten gilt, dann müssen Kohäsin-Komplexe die Chromosomen mehrere Jahrzehnte des Lebens zusammenhalten, bevor sie bei einem Ovulationszyklus zur korrekten Chromosomentrennung beitragen“, erklärt Schuh. Mit fortschreitendem Alter geht das Kohäsin jedoch verloren – zumindest bei der Maus –, was zu einer vorzeitigen Trennung der Schwesterchromatiden während der Reifeteilung I führt. „Wenn die Schwesterchromatiden bereits getrennt sind, dann werden sie zufällig und somit gegebenenfalls eben fehlerhaft zwischen den beiden Spindelpolen verteilt“, erklärt die Wissenschaftlerin. Ob Kohäsin auch in menschlichen Eizellen aus den Chromosomen verloren geht, ist noch nicht klar. Allerdings erfahren Chromosomen in menschlichen Oozyten während der Alterung ähnliche Strukturveränderungen wie die Forschenden sie in Oozyten älterer Mäuse beobachten.
Es besteht also weiterhin Forschungsbedarf und somit viel Arbeit für Melina Schuh und ihr Team in Göttingen. Für die Durchführung entsprechender Studien bedarf es immer wieder auch neuer Methoden, die in Schuhs Abteilung in den vergangenen Jahren entwickelt wurden, wie beispielsweise jene, mit der Proteine aus Eizellen funktional untersucht werden können. Ihr erklärtes Ziel dabei: „Wir möchten mehr Paaren helfen, ihren Kinderwunsch zu erfüllen und auch dazu beitragen, dass es mehr Geburten mit weniger In-vitro-Fertilisationszyklen gibt, dass also Kinderwunschbehandlung effizienter ablaufen kann“, so die Forscherin.
Abbildungshinweise:
Titelbild © Chun So / MPI für Multidisziplinäre Naturwissenschaften
Abb. A: © Zahlen nach Forti, G. (1998), doi: 10.1210/jcem.83.12.5296 // Grafik: HNBM / CC BY-NC-SA 4.0
Abb. B: © Quellen: Carcio, H. A.: Management of the Infertile Woman; Rosenthal, M. S.: The Fertility Sourcebook (1998) // Grafik: HNBM
Abb. C: © Foto: Chun So / MPI für Multidisziplinäre Naturwissenschaften; Grafik: HNBM / CC BY-NC-SA 4.0
Kasten: © MPI für Multidisziplinäre Naturwissenschaften / Grafik: HNBM / CC BY-NC-SA 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
BIOMAX Ausgabe 39, Frühjahr 2024; Text: Dr. Christina Beck; Redaktion: Dr. Tanja Fendt
![]() Mit dieser Ausgabe erscheint das 100. Heft seit Entstehung der MAX-Reihe, die neben dem BIOMAX auch die TECH- und GEOMAX-Hefte umfasst. Seit dem Jahr 1998 ist es das Ziel der Hefte, aktuelle Forschungsergebnisse aus den Max-Planck-Instituten für Schülerinnen und Schüler aufzubereiten und so das Interesse an der Wissenschaft zu wecken.
Mit dieser Ausgabe erscheint das 100. Heft seit Entstehung der MAX-Reihe, die neben dem BIOMAX auch die TECH- und GEOMAX-Hefte umfasst. Seit dem Jahr 1998 ist es das Ziel der Hefte, aktuelle Forschungsergebnisse aus den Max-Planck-Instituten für Schülerinnen und Schüler aufzubereiten und so das Interesse an der Wissenschaft zu wecken.
Zwei Erklärvideos des MPI für Polymerforschung zu den Themen Polymere, Nanokapseln, künstliche Zellen
Herstellung von Nanokapseln (8 min)
Das Video erklärt die einzelnen Syntheseschritte im Labor und welche Qualitätskontrollen durchlaufen werden müssen, um die „perfekte“ Nanokapsel herstellen zu können.
Themen im Film: Synthese von Nanokapseln (ab min 1:05) // Charakterisierung der Nanokapseln (ab min 2:23) // Zellexperimente (ab min 5:03) // Gewebetests ( ab min 6:10) // Anwendung am Menschen (ab min 6:45)
> Zum Film auf der Website des MPI
Nanokapseln als künstliche Zellkompartimente (7 min)
Wie werden künstliche Zellen synthetisiert? Zuerst müssen dafür aktive Nanokapseln mit einer polymeren Zellmembran aufgebaut werden. Die Nanokapseln bilden einzelne Kompartimente, die Funktionen einer biologischen Zelle nachahmen. Forschungs-Teams ist es gelungen, Reaktionen in einer künstlichen Zelle zu rekonstruieren und gezielt zu steuern. Dadurch ist es möglich, die Natur besser zu verstehen und die Erkenntnisse z.B. für die Medizin zukünftig nutzbar zu machen.
Themen im Film: Nanokapseln als Zellkompartiment (ab min 1:28) // Herstellung der Zellmembran (ab min 2:30) // Untersuchung der künstlichen Minikraftwerke und deren Reaktionen (ab min 5:20)
Zum Film auf der Website des MPI
Abbildung: © MPI für Polymerforschung

© wachiwit/Adobe Stock
Unser gesamtes Leben baut auf Fotosynthese auf. Die musste sich im Laufe der Zeit an große Veränderungen in der Umwelt anpassen. Eine neue Studie zeigt, wie dies das Enzym Rubisco geschafft hat und was die Erkenntnis darüber für die zukünftige Fotosynthese und auch unser Klima bedeuten kann.
Themen im Podcast: Enzym Rubisco / Fotosynthese / Anpassungen der frühen Fotosynthese / Rubisco-Varianten / Proteinstammbaum / Opitimierung Rubisco
Zum Podcast vom 24. Oktober 2022 (13 min) © detektor.fm/Max-Planck-Gesellschaft
Die Aufgaben behandeln folgende Themen:
Fotosynthese / Rubisco / Calvin-Zyklus / Chloroplasten / Bewertung gentechnischer Möglichkeiten
Und Fragen zu den Filmen
„Synthetic Chloroplast Production using a Microfluidic platform“ > Film auf YouTube
„Tobias Erb on Designing a More Efficient System for Harnessing Carbon Dioxide“ > Film auf YouTube
Unterrichtsmaterial zum Biomax 37.
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.
YouTube-Link: https://youtu.be/nRQWgcrAVY8
Wissenschaftler wollen Chloroplasten als Fabriken für medizinische Wirkstoffe benutzen. Dafür statten sie die Chloroplasten mit neuen Genen aus, die dann von den Zellorganellen in Proteine übersetzt werden. So könnten Pflanzen eines Tages beispielsweise Antibiotika herstellen.
[Dauer des Videos: 3 min]
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.
YouTube-Link: https://youtu.be/KwYk60FdSNM
Molche können sogar ihr Herz teilweise regenerieren. Dedifferenzierte Zellen sind der Schlüssel zu dieser erstaunlichen Fähigkeit. Thomas Braun will herausfinden, wie fertige Herzzellen ihr Entwicklungsprogramm zurück spulen und sich in einen ursprünglicheren Zustand versetzen können.
[Dauer des Videos: 7 min]
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.
YouTube-Link: https://youtu.be/mjbfD906XVo
Ein Molch kann beinahe alle Körperteile regenerieren. Dazu nutzt er dedifferenzierte Zellen, die sich in verschiedene Zelltypen umwandeln können – Signalstoffe sagen ihnen, in welchen.
[Dauer des Videos: 2 min]
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.