„Die Evolution muss außerordentlich zufrieden gewesen sein. So zufrieden, dass sie drei Milliarden Jahre weitestgehend verschlief. Vielleicht blickte sie auch einfach voller Stolz auf ihr Werk, ohne sich zu Höherem berufen zu fühlen. Sicher, dieser Membransack mit dem Supermolekül im Kern hatte sich als Husarenstück erwiesen, auf das man sich durchaus etwas einbilden konnte. Aber dreieinhalb Milliarden Jahre nichts als Einzeller?“ So flapsig und doch treffend zugleich steigt Frank Schätzing in seinem Buch „Nachrichten aus einem unbekannten Universum“ in die Geschichte der Evolution ein. „Eine winzige Hülle, die im offenen Wasser treiben konnte, dabei aber immer alles hübsch beieinander hatte, was zur Erhaltung einer lebensfähigen Zelle vonnöten war. […] Damit war der Grundbaustein aller komplexen Wesen erfunden. Ein kleines Säckchen voll genetischer Information, ein praktischer Beutel. Die Handtasche der Evolution.“
Mehrfach hat sich dieser „Membransack“ entwickelt, mit unterschiedlichen Resultaten. Archaebakterien und Eubakterien, die „echten“ Bakterien, entstanden. Sie bilden zusammen die Familie der Prokaryonten. Karyon ist das griechische Wort für „Kern“, ein Prokaryont ist also eine Zelle vor der Erfindung des Zellkerns. Archaebakterien und Eubakterien enthalten nämlich kein inneres Membransystem und auch ihre DNA liegt als Molekül frei im Plasma der Zelle vor. Oder wie Schätzing schreibt: „In der Handtasche rutschte immer noch alles wild hin und her.“ Die Eukaryonten umfassen die übrigen Lebewesen. Sie unterscheiden sich von den Prokaryonten vor allem darin, dass sie einen echten Zellkern sowie membranumhüllte Organellen besitzen, von denen einige eigene Erbanlagen (Gene) enthalten.
Neue Lebensformen durch Symbiose
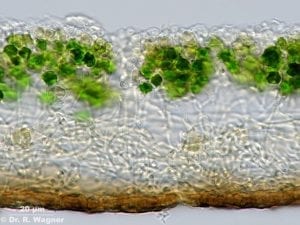
Was genau aber ist passiert, damit aus Prokaryonten Eukaryonten werden konnten – jene Zellen, die als Urväter der drei großen Reiche gelten, der Pilze, Pflanzen und Tiere? Bereits 1867 hatte der Schweizer Botaniker Simon Schwendener erkannt, dass Flechten quasi Doppelorganismen aus Alge und Pilz sind. Sie bestehen aus einem oder mehreren Pilzen, den sogenannten Mycobionten, und einem oder mehreren Photosynthese betreibenden Partnern, den Photobionten. Das sind in der Regel Grünalgen oder Cyanobakterien. [2] Der Pilz bildet fast immer den eigentlichen Vegetationskörper, ein Geflecht aus Pilzfäden (Hyphen); darin eingeschlossen befindet sich eine Population der Photobionten (Abb. A). Die Vorteile der Symbiose liegen stark auf der Seite des Mycobionten: Er wird von seinem Photobionten, der Alge, mit Nährstoffen versorgt, welche diese durch Photosynthese bildet. Schwendener schrieb daher auch von einer „Versklavung“ der eingefangenen Alge durch den Pilz; heute sprechen Forscher eher von „kontrolliertem Parasitismus“.
 [3]
[3]Abb. A: Oben liegt eine Rindenschicht aus dichtem Pilzmycel und darunter folgt eine Schicht mit den symbiontischen Grünalgen. Unter dieser Algenschicht folgt dann lockeres Pilzmycel und den Abschluss nach unten bildet eine braune Rindenschicht, gebildet aus dicht verfilzten Hyphen.
© Dr. R. Wagner
Die Eigenschaften der Flechten unterscheiden sich deutlich von jenen der Organismen, aus denen sie sich zusammensetzen. So bilden sich erst in der Symbiose die typischen Wuchsformen der Flechten heraus, und nur in Lebensgemeinschaft mit einem Photobionten bilden die Mycobionten die charakteristischen Flechtensäuren. Für den russischen Naturforscher Konstantin Mereschkowski lieferten Flechten daher einen ersten Hinweis darauf, dass neue Lebensformen durch Kombination von Einzelorganismen entstehen können. 1905 veröffentlichte er eine erste theoretische Arbeit, „Über Natur und Ursprung der Chromatophoren im Pflanzenreich“, die noch heute als die grundlegende Publikation zur Endosymbiontentheorie gilt. Sie sollte sich als revolutionär erweisen für das Verständnis vom Ursprung eukaryotischen Lebens.
Wohngemeinschaft mit gravierenden Folgen
Die Idee war allerdings nicht neu, andere Biologen, u.a. Andreas Schimper, hatten sich bereits in den 1880er-Jahren darüber Gedanken gemacht. Doch erst Mereschkowski legte eine schlüssige Herleitung vor, dass Chloroplasten – jene Organellen, in denen die Photosynthese, also der Aufbau von Glucose aus Kohlendioxid und Wasser im Sonnenlicht, stattfindet – auf ehemals frei lebende Prokaryonten zurückgehen: Sie waren von artfremden, eukaryotischen Wirtszellen aufgenommen, aber nicht verdaut worden, sondern hatten zunächst eine stabile Form der Partnerschaft mit den Wirtszellen gebildet. „Das war der Moment, in dem die Wohngemeinschaft erfunden wurde, wissenschaftlich Endosymbiose. Sozusagen Kommune 1“, schreibt Schätzing.
Ein wichtiges Indiz war für Mereschkowski die Tatsache, dass Chloroplasten immer durch Teilung aus ihresgleichen hervorgehen, und nicht, wie man es von Zellbestandteilen erwarten würde, im Zyklus der Zellteilung neu gebildet werden. Ferner besaßen die blaugrün gefärbten Plastiden auffallende physiologische und morphologische Ähnlichkeiten mit den photosynthetisch aktiven Cyanobakterien. Auch wenn die Beobachtung dieser extrem kleinen Organismen mit Mikroskopen zu dieser Zeit alles andere als einfach war – Mereschkowski war überzeugt: Cyanobakterien besaßen weder einen Kern noch Chloroplasten; das Cyanobakterium als Ganzes war ein einzelner Chloroplast. Auch die gut bekannten Fälle von Symbiose unterstützten seine Behauptung, dass Chloroplasten in Wirklichkeit Cyanobakterien sind. Mereschkowski wies auf Algen (Zoochlorellen und Zooxanthellen) hin, die symbiotisch in Protozoen, Süßwasserschwämmen, Hydra und bestimmten Plattwürmern leben. Symbiotische Algen, so sein Argument, konnten in fast jeder Klasse von „niederen wirbellosen Tieren“ gefunden werden.
Eine Fülle von Belegen
Was Mereschkowski noch nicht wissen konnte, haben inzwischen moderne Methoden der Molekularbiologie enthüllt: Studiert man die Struktur von Plastiden (und übrigens auch von Mitochondrien) genau, fällt auf, dass sie sich durch zwei Hüllmembranen gegen das Cytoplasma abgrenzen – als Ergebnis der Phagocytose, also der Einverleibung einer Zelle in eine andere. Dabei ist die äußere Membran typisch eucytisch, die innere hingegen weist protocytische, also bakterielle Merkmale auf. Chloroplasten besitzen eine eigene zirkuläre DNA; DNA-Vervielfältigung und Proteinherstellung ähneln dabei denen von Bakterien. So besitzt die Chloroplasten-DNA bakterienartige Promotoren, das sind jene Sequenzbereiche, welche das Ablesen eines Gens regulieren. Anders als eukaryotische Zellen besitzen Chloroplasten sogenannte 70S-Ribosomen, die auch für Bakterien charakteristisch sind. Und ihre Gene weisen eine hohe Übereinstimmung mit cyanobakteriellen Genen auf.
Es gibt somit eine Fülle von Belegen für die Endosymbiontentheorie, was aber nicht heißt, das nicht auch noch viele Fragen offen wären, insbesondere wie beziehungsweise wie oft und wann genau die verschiedenen Stufen der Endosymbiose stattgefunden haben. Hier liegt noch vieles im Dunkeln. Bezüglich des „Wie oft“ der Chloroplasten-Bildung kann die Wissenschaft immerhin schon sagen, dass alle Chloroplasten (auch die komplexen) der (ein- und mehrzelligen) Algen und Landpflanzen monophyletischen Ursprungs sind, also auf ein einzelnes Endosymbiose-Ereignis zurückgehen. Über das „Wann“ bestand allerdings lange Zeit Uneinigkeit: Die Datierungen für den gemeinsamen Vorfahren aller Eukaryonten gingen weit auseinander – sie variierten zwischen 1,5 und 2,8 Milliarden Jahren.
Eine neue Zeittafel der Evolution
Die Kluft von mehr als einer Milliarden Jahre tat sich auf zwischen fossilen Funden und chemischen Spuren: Um die Entstehung höherer Lebewesen nachzuvollziehen, haben Wissenschaftler bestimmte Fettmoleküle, sogenannte Steroide, analysiert, die in den Zellwänden eukaryotischer Organismen enthalten sind. Steroid-Moleküle können in altem Sediment, also dem versteinerten Grund urzeitlicher Gewässer, als Sterane erhalten bleiben. Einige Wissenschaftler hatten solche molekularen Spuren vermehrt in Proben von 2,5 bis 2,8 Milliarden Jahre alten Sedimenten identifiziert und daraus geschlussfolgert, dass eukaryotische Algen bereits in dieser Zeit entstanden sein müssen. Andererseits finden sich die ältesten fossilen Mikroalgen, welche unumstritten als Überbleibsel von Eukaryonten gelten, bisher nur in etwa 1,5 Milliarden Jahre altem Gestein im Norden Australiens. Könnten die chemischen Proben kontaminiert gewesen sein?
2015 haben Wissenschaftler des Max-Planck-Instituts für Biogeochemie in Jena zusammen mit US-amerikanischen Kollegen eine neue Methode entwickelt, um 2,7 Milliarden alte Gesteine, die als steroidhaltig eingestuft wurden, auf extrem saubere Weise zu beproben. Die hochempfindlichen Massenspektrometer der verschiedenen Labore konnten nicht einmal Pikogramm-Mengen eukaryotischer Steroide detektieren. „Das gesamte organische Material in diesen Proben wurde im Laufe der Jahrmillionen durch Druck und Temperatur verändert – keine Biomarker-Moleküle hätten dies überlebt“, sagt der Max-Planck-Forscher Christian Hallmann. Somit können die vermeintlich 2,7 Milliarden Jahre alten Steroidmoleküle nicht mehr als Beweis herhalten, dass Eukaryonten bereits viel früher entstanden sind, als Fossilienfunde belegen.
Ohnehin hatten die bisherigen chemischen Daten den Forschern einiges Kopfzerbrechen bereitet: Da alle Eukaryonten Sauerstoff benötigen, muss die Entwicklung der Sauerstoff-produzierenden Photosynthese dem evolutionären Übergang zu den Eukaryonten vorausgegangen sein. Diese biochemische Innovation, bekannt als „Sauerstoff-Krise“, in deren Folge sich der gesamte Planet veränderte, wird eindeutig auf 2,5 bis 2,4 Milliarden Jahre vor unserer Zeit datiert. Bislang ließ sich schwer erklären, wie die Eukaryonten schon mehrere 100 Millionen Jahre vorher entstanden sein konnten, wenn sie doch unbedingt Sauerstoff brauchten.
Spektakuläre Fossilienfunde in Indien
Inzwischen gibt es weitere Entdeckungen: So haben schwedische Forscher 2017 in Zentralindien die womöglich bisher ältesten Fossilien eukaryotischer Zellen entdeckt. Fündig wurden sie in der rund 1,6 Milliarden Jahre alten Chitrakoot-Formation. Dieses Sediment entstand einst in einem flachen Küstengewässer, in dem Kolonien von fädigen Cyanobakterien lebten. Ihre typischen, röhrenförmigen Relikte sind als Stromatolithen im Gestein erhalten geblieben.
 [4]
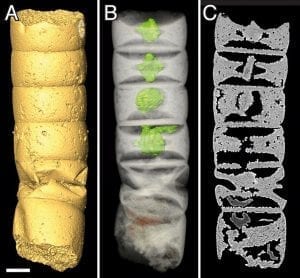
[4]Abb. B: Röntgentomografie eines der fossilen Zellröhrchen (Rafatazmia chitrakootensis), Balken 50 µm: (A) Oberfläche (B) Durchsicht mit rhombischen Strukturen, eingefärbt (C) virtueller Längsschnitt.
© Bengtson et al./PLoS Biology https://doi.org/10.1371/journal.pbio.2000735
Zwischen den fossilen Cyanobakterien entdeckten die Forscher jedoch einige Röhrchen, die mit bis zu zwei Millimetern Länge deutlich größer waren und eine ungewöhnliche innere Struktur besaßen, wie Mikro-Computertomografie-Aufnahmen enthüllten (Abb. B). Die Forscher vermuten, dass es sich bei diesen intrazellulären Strukturen um eine frühe Form von Plastiden handelt. Sollte sich dies bestätigen, wären diese 1,6 Milliarden Jahre alten Mikrofossilien eine der ältesten, wenn nicht der älteste gesicherte Fund eukaryotischer Zellen.
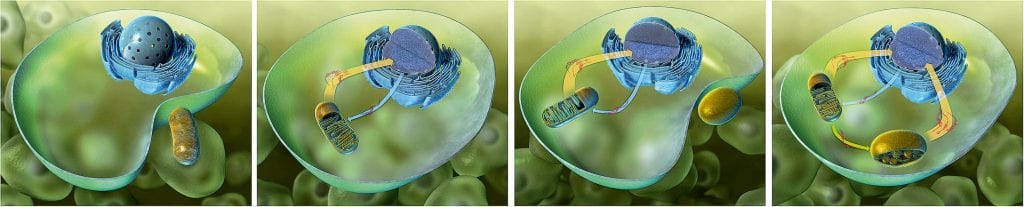
Was als „lockere Wohngemeinschaft“ vor etwa anderthalb Milliarden Jahre begann, führte bei den Symbionten zu einer Co-Evolution, in deren Verlauf diese ihre Autonomie verloren und zu Organellen umgestaltet wurden. Dabei wurden Teile der Symbionten-DNA in das Kerngenom der Wirtszelle integriert (Abb. C). Forscher nehmen an, dass die endosymbiotisch lebenden Cyanobakterien und Proteobakterien (Vorläufer der Mitochondrien) bis zu 90 Prozent ihres Genoms in den Kern der Wirtszelle transferiert haben. Ein solcher funktionaler Gentransfer setzt jedoch voraus, dass die Gene an richtiger Stelle in das Kerngenom eingebaut werden, damit sie abgelesen werden können. Da die Übertragung Tausender Gene aus den Organellen in den Kern in riesigen evolutionären Zeiträumen ablief und demzufolge niemand jemals ein solches Ereignis beobachten konnte, entzog sich diese Frage bislang jeder Überprüfung. „Erst neue Technologien, die es erlauben, Chloroplastengenome höherer Pflanzen gentechnisch zu verändern, haben es uns in den vergangenen Jahren ermöglicht, wichtige Schritte dieses evolutionären Prozesses im Labor – quasi im Zeitraffer – nachzuvollziehen und die molekularen Grundlagen des Gentransfers zwischen Organellen- und Kerngenomen zu analysieren“, erklärt Ralph Bock, Direktor am Max-Planck-Institut für molekulare Pflanzenphysiologie.
 [5]
[5]Abb. C: Die Vorläufer der Organellen waren freilebende Bakterien, die von einer „Urzelle“ umschlossen wurden. Auf diese Weise entstanden aus Proteobakterien Mitochondrien und aus Cyanobakterien Chloroplasten. Die Pfeile geben die Richtung und den Umfang des Gentransfers an.
© Jochen Stuhrmann
Gentransfer im Zeitraffer
Der Max-Planck-Forscher und sein Team brachten ein zusätzliches Gen in die Chloroplasten von Tabakpflanzen ein. Dieses Gen vermittelt eine Resistenz gegen das Antibiotikum Kanamycin – allerdings nur dann, wenn es sich im Erbgut des Zellkerns befindet. Folglich konnten die gentechnisch veränderten Pflanzenzellen nur resistent gegen Kanamycin sein, wenn das Gen von den Chloroplasten in den Kern der Zellen eingewandert und dort erfolgreich ins Erbgut integriert worden war. Um das zu testen, überführten die Forscher die Pflanzenzellen in eine Gewebekultur und brachten diese auf einem mit Kanamycin versetzten Nährmedium aus. Zellen, die hier überlebten, mussten das Resistenzgen aus dem Plastidengenom in das Kerngenom transferiert haben. Aus solchen Zellen können schließlich komplette, gegen das Antibiotikum resistente Pflanzen wachsen. „Die Häufigkeit, mit der sich ein solcher Gentransfer vollzogen hat, übertraf alle unsere Erwartungen“, sagt Ralph Bock: „In etwa einer von fünf Millionen Zellen war das Gen in den Zellkern gelangt.“ Wie viel dies ist, wird deutlich, wenn man sich klarmacht, dass ein einziges Blatt aus wesentlich mehr als fünf Millionen Zellen besteht.
Nun führt der Transfer eines Gens aus den Chloroplasten in den Zellkern nicht automatisch zu einem funktionierenden Kern-Gen. Der Grund dafür ist, dass sich prokaryotische, also bakterielle Organellen-Gene und eukaryotische Kern-Gene strukturell unterscheiden. Beim oben beschriebenen Experiment umgingen die Forscher dieses Problem, indem sie das Gen, welches die Kanamycin-Resistenz vermittelt, mit eukaryotischen Steuerelementen (Promotor, Terminator) versahen. Somit war es unmittelbar nach dem Einfügen im Kerngenom auch aktiv. Beim evolutionären Gentransfer ist dies jedoch nicht der Fall: Das transferierte Gen wird zwar in den Zellkern eingebaut, kann dort aber in aller Regel zunächst nicht abgelesen werden – es sei denn, in einem zweiten Schritt wird ein eukaryotischer Promotor vor das Gen eingebaut.
Der Zufall spielt mit
Um zu prüfen, ob ein solches Ereignis ebenfalls stattfindet, haben die Forscher ein weiteres Gen – dieses Mal allerdings mit bakterieller Genstruktur – in das Chloroplastengenom eingeführt, das eine Resistenz gegen das Antibiotikum Spectinomycin vermittelt. Im Zug des Experiments entstanden somit Pflanzen, bei denen sich im Zellkern ein funktionierendes Kanamycin-Resistenzgen nebst einem inaktiven (weil bakteriellen) Spectinomycin-Resistenzgen befand. Folglich sollten diese Pflanzen resistent gegen Kanamycin, aber empfindlich gegenüber Spectinomycin sein. Tatsächlich traten in den Kultivierungsexperimenten in acht selektierten Pflanzenlinien jedoch Resistenzen auch gegen Spectomycin auf, ergo musste das entsprechende Gen aktiv geworden sein. „Es zeigte sich, dass in jedem dieser Fälle durch die Deletion eines kleineren Stücks DNA ein aktiver Promotor vor das Gen gelangt war“, erklärt Bock. Dieser molekulare Umbau reichte aus, um das Spectinomycin-Resistenzgen zu aktivieren. Damit konnten erstmals Vorgänge, die sonst in erdgeschichtlichen Zeiträumen ablaufen, im Zeitraffer nachvollzogen und die zugrunde liegenden Mechanismen aufgeklärt werden. Es ist somit nicht überraschend, dass es verschiedenen Endosymbionten innerhalb weniger Millionen Jahre gelang, einen guten Teil ihres Genoms in den Wirtskern auszulagern und zu aktivieren.
Abteilungsteilung, ein cleverer Einfall
Und wie ging es weiter? „Nun sind Einzeller zwar klein, so klein aber auch wieder nicht. Man hat errechnet, dass eine ungebremste Vermehrung die Erde binnen weniger Tage mit Einzellern regelrecht überzogen hätte. Lückenlos! Die frühe Schöpfung wäre an sich selbst erstickt. […] War die Idee mit der Handtasche doch nicht so genial gewesen?“ Und damit beginnt laut Schätzing „Miss Evolutions dritter Geniestreich“: „Ihr Plan war auf Spezialisierung ausgerichtet. […] Das große Geheimnis der Vielzeller ist, dass sie nicht einfach Zusammenballungen von Mikroben sind, sondern ihre Zellen sich die Arbeit am heranwachsenden Organismus teilen.“ Also sorgte Miss Evolution auch dafür, dass nur ganz bestimmte Zellen zur Fortpflanzung fähig waren. Und jetzt kommt die Sache mit dem Sex – aber das ist eine andere Geschichte.
Abbildungshinweise:
Titelbild: Cartoon Zellen © The Amoeba Sisters
Abb. A: Querschnitt Flechte © Dr. R. Wagner
Abb. B: Eukaryoten-Urahn © Bengtson et al./PLoS Biology https://doi.org/10.1371/journal.pbio.2000735
Abb. C: Pflanzenzellentwicklung © Jochen Stuhrmann
Der Text wird unter CC BY-NC-SA 4.0 [6] veröffentlicht.
BIOMAX Ausgabe 34, Winter 2017/2018; Autorin: Christina Beck
