© HNBM
Ohne Katalysatoren sähe unsere Welt anders aus. So wäre etwa die Luftqualität schlechter, weil Autos mehr Schadstoffe ausstoßen würden. Etliche Dinge um uns herum, vielleicht sogar die meisten, würde es gar nicht geben. Keine Kunststoffe, weniger Medikamente, und mangels Kunstdünger würden noch viel mehr Menschen hungern. Auch bei der Reduktion klimaschädlicher Emissionen helfen Katalysatoren. Sie entfernen beispielsweise das Treibhausgas Distickstoffoxid aus Abgasen, die unter anderem bei den Synthesen von Salpetersäure und Nylon-Rohstoffen entweichen.
Wir verdanken den Reaktionsbeschleunigern also eine ganze Menge. Schätzungen zufolge sollen Katalysatoren bei 80 bis 90 Prozent aller chemischen Prozesse im Einsatz sein. „Es wurde kalkuliert, dass die damit geschaffenen Produkte bis zu einem Drittel des weltweiten Bruttoinlandsprodukts beitragen“, sagt Benjamin List über sein Arbeitsgebiet, die Katalysatorforschung. Der Chemiker ist Direktor am Max-Planck-Institut für Kohlenforschung und hält die Katalyse für „eine der wichtigsten Technologien der Menschheit“.
Die Geschichte der Katalyse ist praktisch so alt wie die der Chemieindustrie. Auch ohne theoretischen Hintergrund und ohne die Mechanismen zu kennen, lernten die Praktiker früh, dass viele wichtige Reaktionen unter bestimmten Bedingungen schneller ablaufen. Als eines der ersten Beispiele der industriellen Katalyse gilt das 1746 entwickelte Bleikammerverfahren für die Schwefelsäuregewinnung. Dabei katalysiert Stickstoffdioxid die Oxidation von Schwefeldioxid zu Schwefeltrioxid. Beim im 19. Jahrhundert entwickelten Kontaktverfahren wirkte erst Platin und später Vanadiumpentoxid als Katalysator. Egal ob Chlor, Salpetersäure, Kunststoffe, Methanol, der blaue Farbstoff Indigo oder das für die Düngemittelherstellung wichtige Ammoniak – bei den Synthesen unzähliger wichtiger Chemikalien sorgen erst Katalysatoren für nennenswerte Umsetzungsgeschwindigkeiten.
Schmieröl im Räderwerk
Eine der frühesten Definitionen der Katalyse stammt von Wilhelm Ostwald, der sich Ende des 19. Jahrhunderts intensiv mit dem Einfluss von Katalysatoren auf chemische Reaktionen beschäftigt hatte. Darin trug er dem Effekt auf die Reaktionsgeschwindigkeit bereits Rechnung. Später leitete man daraus die bis heute gültige Beschreibung ab, nach der ein Katalysator ein Stoff ist, der die Geschwindigkeit einer chemischen Reaktion erhöht oder den Ablauf einer Reaktion erst ermöglicht, ohne dabei selbst verbraucht zu werden. Ostwald verglich diesen Effekt mit der Wirkung von Schmieröl auf die Räder eines Uhrwerks. In beiden Fällen würden vorhandene Widerstände herabgesetzt: im Uhrwerk der durch die mechanische Reibung, im Chemiereaktor der durch die Energiebarriere. Für seine grundlegenden Arbeiten erhielt Ostwald 1909 den Nobelpreis für Chemie.
Wichtig in diesem Zusammenhang: Ein Katalysator kann nur solche Reaktionen beschleunigen oder ermöglichen, die auch thermodynamisch begünstigt sind, bei denen also das Energieniveau der Produkte niedriger liegt als das der Edukte. Genauso wichtig: Das thermodynamische Gleichgewicht einer Reaktion wird von Katalysatoren nicht beeinflusst. Kennzeichnend für einen Katalysator ist, dass er die Aktivierungsenergie herabsetzt, die aufgewendet werden muss, um bestehende Bindungen zu lösen, damit ein neuer Zustand mit neuen Bindungen entstehen kann. Üblicherweise senken Katalysatoren diesen Energieaufwand, indem sie besondere Übergangszustände ermöglichen, die mit weniger Energieeinsatz zu erreichen sind. Sie tun dies, indem sie beispielsweise vorübergehend kovalente oder Wasserstoffbrücken-Bindungen mit einem der Reaktionspartner eingehen – und so dessen Reaktivität beeinflussen.
Übrigens stimmt das mit dem „Nicht-verbraucht-Werden“ in der Praxis nicht immer. Gerade in der heterogenen Katalyse, bei der die Katalysatoren meistens auf einer festen Phase aufgebracht sind, kommt es im Laufe des Prozesses durchaus zu Veränderungen, etwa zu Verkokungen oder Sintervorgängen. Die Betreiber solcher Prozesse müssen ihr Katalysatormaterial daher von Zeit zu Zeit erneuern.

Wie bedeutsam die Katalyse für die Chemie ist, beweist auch ein Blick nach Stockholm. Nach Wilhelm Ostwald wurden dort viele weitere Wissenschaftler namentlich für Fortschritte in der Katalyseforschung mit dem Chemie-Nobelpreis ausgezeichnet (Abb. A). Im Jahr 2021 ehrte man Benjamin List und David MacMillan mit dem renommierten Preis – und zwar „für die Entwicklung asymmetrischer Organokatalysatoren“. Um die Jahrtausendwende herum hatten beide Forscher, unabhängig voneinander, die Tür zu diesem neuen Spezialgebiet der Katalyse aufgestoßen.
Erwünschtes Spiegelbild
Von Organokatalyse sprechen Chemiker, wenn es sich bei den Katalysatoren um organische Moleküle handelt. Dass diese chemische Reaktionen beschleunigen können, ist lange bekannt. Schon Justus von Liebig machte vor bald 200 Jahren davon Gebrauch, als er unter anderem für die Bildung aromatischer α-Hydroxyketone Cyanid als Katalysator einsetzte oder später den katalytischen Effekt von Acetaldehyd auf eine andere Synthese entdeckte. Neu an den Arbeiten von List und MacMillan war aber die asymmetrische Synthese mit organischen Katalysatoren. Mit „asymmetrisch“ sind Reaktionen gemeint, die selektiv nur zu einem von zwei möglichen Enantiomeren führen. Diese Spiegelbildisomer-Paare gibt es zum Beispiel dann, wenn ein Molekül ein Stereozentrum enthält.
Synthesen, die selektiv vor allem zu einem Enantiomer führen, sind häufig bei Substanzen gefragt, die in biologischen Systemen eingesetzt werden sollen, also zum Beispiel bei Medikamenten, Mitteln für die Schädlingsbekämpfung oder auch bei Duft- und Aromastoffen. Das liegt daran, dass oft nur eines der beiden Enantiomere den gewünschten Effekt hat, also etwa eine pharmazeutische Wirkung oder einen bestimmten Geruch und Geschmack. Einer Abschätzung aus dem Jahr 2017 zufolge besitzt etwa jede zweite in der Medizin eingesetzte Substanz ein Stereozentrum. Doch längst nicht in allen Fällen gelingt den Herstellern eine enantioselektive Synthese.
Die Anforderungen an einen asymmetrischen Katalysator sind hoch. Es reicht nicht, wenn er lediglich die Aktivierungsenergie senkt. Um dabei auch noch enantioselektiv auf den Reaktionsverlauf zu wirken, muss er eine ganz bestimmte räumliche Umgebung für die an der Reaktion beteiligten Moleküle schaffen. Erst sie führt dazu, dass zum Beispiel die Anlagerung eines Reaktionspartners an den anderen nur von einer Seite aus erfolgen kann, weil die andere abgeschirmt wird. Bei Enzymen sorgt die komplexe Struktur des Eiweißmoleküls für diese „sterische Kontrolle“. Bei Katalysatoren auf Basis von Übergangsmetallen erreicht man den Effekt dadurch, dass man die Metallatome zuvor mit geeigneten Molekülgerüsten, auch Liganden genannt, umgibt. In beiden Fällen führt die entscheidende Reaktion aus räumlichen (sterischen) Gründen bevorzugt nur zu einem Enantiomer, während die Bildung des Spiegelbild-Moleküls deutlich erschwert ist.
Kontrollierte Reaktionen
Es ist noch gar nicht lange her, da ist man davon ausgegangen, dass ausschließlich die genannten Übergangsmetall-Komplexe und Enzyme für asymmetrische Katalysen in Frage kommen. Erst die Nobelpreisträger von 2021 haben das Konzept etabliert, dass sich auch kleine organische Moleküle wie etwa Prolin dafür eignen (Abb. B).
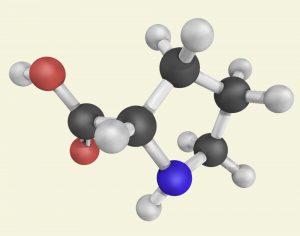
Abb. B: L-Prolin wird im menschlichen Körper zum Beispiel für die Bildung von Kollagen benötigt. Die Entdeckung seiner katalytischen Wirkung eröffnete das Feld der asymmetrischen Organokatalyse. Das Molekül ist klein, kostengünstig, ungiftig und steuert äußerst selektiv chemische Reaktionen.
© ibreakstock / Adobe Stock
Benjamin List forschte zunächst an Proteinkatalysatoren auf Antikörperbasis. Durch Kristallstrukturanalysen stellte sich heraus, dass an der Katalyse sowohl eine Amino- als auch eine Säuregruppe des Antikörpers beteiligt waren. List fragte sich: „Hat ein einfaches organisches Molekül vielleicht dieselbe Wirkung, wenn es eine Amino- und eine Säuregruppe besitzt?“ Also zum Beispiel eine Aminosäure? In seinem ersten Versuch testete er, ob die natürliche Aminosäure L-Prolin die Aldolreaktion von Aceton mit Aldehyden enantioselektiv katalysieren könnte. Es gelang: Der dabei von Keton und Prolin gebildete Enamin-Zustand ging tatsächlich räumlich kontrollierte Reaktionen mit Aldehyden ein (Abb. C).
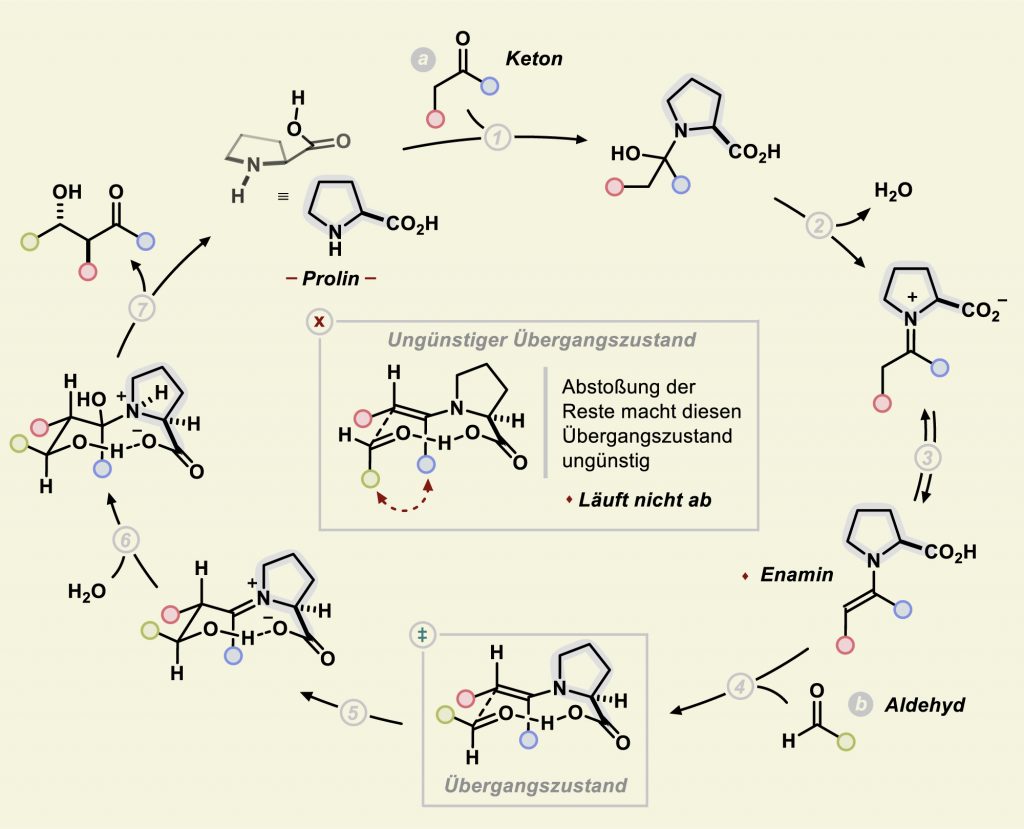
Abb. C: Enamin-Katalyse mit Prolin: Über sein Stickstoff-Atom bindet Prolin zunächst an den Kohlenstoff der Carbonyl-Gruppe (1) eines Ketons (a). Nach Wasserabspaltung (2) und Umlagerung (3) entsteht ein Enamin. Dieses greift nukleophil am Kohlenstoff-Atom der Carbonyl-Gruppe eines Aldehyds an (4). Das kann theoretisch von zwei Seiten erfolgen, doch einer der beiden Übergangszustände ist deutlich begünstigt. Der Wasserstoff der Säuregruppe im Prolin stabilisiert den Übergangszustand zunächst und bindet dann an das O-Atom aus dem Aldehyd (5). Nach anschließender Hydrolyse (6) entsteht das Produkt (7) und das wieder frei gewordene Prolin-Molekül kann den nächsten Zyklus starten. Die Enantioselektivität besteht in einer klar bevorzugten Lage der OH-Gruppe am Stereozentrum des Produkts – und resultiert aus dem begünstigten Übergangszustand.
© S. Brunen, MPI für Kohlenforschung / CC BY-NC-SA 4.0
Einfach und nachhaltig
Seit dieser Arbeit sind erst etwas mehr als 20 Jahre vergangen. In dieser Zeit hat sich das Feld der Organokatalyse rasant entwickelt. Viele Forschungsgruppen in aller Welt beschäftigen sich damit. Das ist kein Wunder: Anders als die meisten Metallverbindungen sind Organokatalysatoren in der Regel einfacher (und prinzipiell aus nachhaltigen Rohstoffen) herzustellen, meistens günstiger im Preis und ungiftig. Übergangsmetalle müssen dagegen häufig unter ökologisch schwierigen Bedingungen aus ohnehin begrenzten und zum Teil schwer zugänglichen Erzvorkommen gewonnen werden. Und im besten Fall sind auch die Reaktionsbedingungen moderat. Die Aldolreaktion mit Prolin etwa verläuft in wenigen Stunden bei Raumtemperatur. Gründe genug also, möglichst viele chemische Reaktionen mithilfe organischer Katalysatoren zu beschleunigen.
Dass sich diese prinzipiell auch für asymmetrische Katalysen eignen, hat die Forschung besonders beflügelt. Denn diese Reaktionen bereiten der Industrie häufig Kopfzerbrechen. Gelingt eine enantioselektive Kontrolle der Reaktion nicht, hat dies gleich zwei Nachteile. Zum einen reduziert es die Ausbeute des gewünschten Enantiomers, wenn ein Teil der Ausgangsstoffe zum unerwünschten Isomer reagiert. Zum anderen verursacht es Aufwand, Energie und Kosten, das gewünschte Enantiomer von seinem Spiegelbild abzutrennen. Hersteller sind also bestrebt, die Synthese möglichst selektiv zu gestalten. Es gibt aber immer noch Fälle, in denen eine enantioselektive Synthese bisher gar nicht gelang und Hersteller geringere Ausbeuten und eine Enantiomeren-Trennung in Kauf nehmen müssen. Etliche Medikamente enthalten der Einfachheit halber das Racemat, also die Mischung beider Enantiomere. Das geht natürlich nur, wenn die unerwünschte Variante des Moleküls unschädlich ist.
Zauberstab der Chemie
Vor diesem Hintergrund können organische Katalysatoren durchaus neue Akzente setzen. So etwa bei der Synthese von Sitagliptin, einem Wirkstoff in Medikamenten zur Behandlung von Typ-2-Diabetes. Für den letzten Syntheseschritt, eine enantioselektive Hydrierung, gibt es seit einigen Jahren auch eine Lösung mit einem organischen Katalysator, einem sogenannten Dithiomalonat, der technische Herausforderungen beim Einsatz der früher üblichen Metallkatalysatoren vermeidet. Ein weiteres Beispiel ist die Reaktion von Blausäure mit 2-Butanon, die zu einer wichtigen Vorstufe einiger Arzneimittelwirkstoffe führt. Lange Zeit gab es keine nennenswert enantioselektive Route. Im Jahr 2022 publizierte Benjamin List mit seinem Team erstmals eine organische Katalyse mit hoher Enantioselektivität. Das Katalysatormolekül ist deutlich größer und komplexer als Prolin. „Das ist inzwischen üblich“, erklärt List, „und liegt unter anderem daran, dass wir damit eine stärkere räumliche Kontrolle auf Reaktionen gewinnen.“ Außerdem würden heutige Katalysatormoleküle gezielt so designt, dass sie deutlich effektiver wirken, man also weniger von ihnen benötigt. Musste man Prolin für die Aldolreaktion noch in Konzentrationen von mehr als 20 Prozent den Reaktionspartnern beimischen, genügen bei vielen modernen Organokatalysatoren weniger als ein Prozent, zum Teil sogar deutlich weniger.
Dass im Extremfall ein einziges Katalysator-Molekül ausreicht, um damit Produkte im Tonnenmaßstab herzustellen, ist für Benjamin List gerade das Faszinierende an seinem Arbeitsgebiet. Er spricht auch gerne von „magischen Molekülen“, weil man sie durchaus mit „dem Zauberstab“ eines Magiers vergleichen könne. „Der Zauberer verwandelt Gegenstände damit, wir Chemiker wandeln Moleküle um“, so List.
Lösungen für die Zukunft
Mit seinem Team arbeitet der Nobelpreisträger unermüdlich an weiteren Katalyse-Innovationen (Abb. D) – durchaus auch mit dem Ziel, die Chemie tiefgreifend zu verändern. Unter anderem hofft List, dass sich viele wichtige Chemikalien in Zukunft einfacher und in weniger Reaktionsschritten synthetisieren lassen, vielleicht sogar direkt aus den Bestandteilen des Erdöls, das vorerst für viele chemische Produkte ein unersetzlicher Rohstoff bleibe.

Abb. D: Benjamin List und seine Mitarbeitenden entwickeln gemeinsam Ideen für neue Reaktionen. Als Tafel dient ihnen dabei die Frontscheibe eines Abzugs.
© David Ausserhofer/MPG
Für wie wichtig Benjamin List Katalysatoren bei der Bewältigung der Zukunftsaufgaben hält, hat er in seinem Vortrag anlässlich der Nobelpreisverleihung unterstrichen, als er sagte: „Die aktuellen Herausforderungen für die Menschheit, wie Klimawandel oder Energiekonversion, werden nur mit Hilfe der Katalyse gelingen.“ In Bezug auf das wichtigste Treibhausgas, das Kohlenstoffdioxid, hat er persönlich eine ganz besondere Vision. In kühnen Momenten träumt er davon, dieses Gas einfach aus der Atmosphäre herauszuholen und mittels UV-Licht direkt in Kohlenstoff und Sauerstoff zu zerlegen. „Den Kohlenstoff könnte man verbuddeln“, sinniert List. Voraussetzung für das ganze Szenario wäre aber zunächst ein geeigneter Katalysator, der die starken Doppelbindungen zwischen Kohlenstoff und den beiden Sauerstoffatomen knackt, ohne dass sich direkt neue Bindungen bilden.
Dennoch wird es nicht für jede Reaktion einen organischen Katalysator geben können. Und dort, wo es ihn gibt, muss das nicht automatisch die bessere Lösung sein. Auch Benjamin List räumt ein, dass es Fälle gebe, wo „Metall-Katalysatoren kaum zu ersetzen sind“. Der Max-Planck-Forscher hält die Organokatalyse aber für ein „wichtiges weiteres Werkzeug“ im Repertoire. Metalle und Enzyme behielten gleichwohl ihre Daseinsberechtigung in der Katalyse. Allerdings gelte in der Regel: Bringen organische Moleküle auch nur annähernd dieselbe Effizienz, dann haben sie oft klare Vorteile, wie zum Beispiel die größere Nachhaltigkeit. Letztlich geht es schließlich für die gesamte Chemiebranche auch darum, „grüner“ zu werden. Das heißt, mit Prozessen zu arbeiten, die weniger Energie benötigen, auf möglichst nachhaltigen Rohstoffen basieren und kaum Abfall verursachen.
Abbildungshinweise:
Titelbild: © HNBM
Abb. B: © ibreakstock / Adobe Stock
Abb. C: © S. Brunen, MPI für Kohlenforschung / CC-BY-NC-SA 4.0 [1]
Abb. D: © David Ausserhofer / MPG
Der Text wird unter CC BY-NC-SA 4.0 [1] veröffentlicht.
TECHMAX 30, Sommer 2022; Text: Dr. Karl Hübner; Redaktion: Dr. Tanja Fendt