Eine Zeitreise, die im Jahr 1864 beginnt, zeigt, wie der Erkenntnisfortschritt in der Genetik funktioniert: Im Klostergarten des Augustinerstifts in Alt-Brünn führt der Mönch Johann Gregor Mendel Kreuzungsversuche u.a. mit Erbsen durch. Dabei stößt er auf Gesetzmäßigkeiten, nach denen bestimmte Merkmale von Generation zu Generation weitergegeben werden. Mendel schickt seine Arbeit an einen namhaften Biologen, der diese – wohl auch aus Abneigung gegen die Mathematik – mit ablehnendem Kommentar zurücksendet. 1865 wird der Aufsatz dann doch noch vom Brünner Naturforschenden Verein veröffentlicht, ohne jedoch größere Aufmerksamkeit zu erlangen. Erst ein Zufall bringt Mendels Arbeit im Jahr 1900 an die wissenschaftliche Öffentlichkeit.
Seither plagen sich ganze Schülergenerationen mit den Mendelschen Regeln – und der dazugehörigen Mathematik. Die Chromosomen, die an der Vererbung beteiligten Grundstrukturen, sind in den achtziger Jahren des 19. Jahrhunderts von Walter Fleming entdeckt und untersucht worden. Doch niemand ahnt zu diesem Zeitpunkt, dass sie mit der Vererbung zu tun haben könnten. Auch die Desoxyribonukleinsäure (DNA) in Zellkernen ist durch die Entdeckung von Friedrich Miescher bereits seit 1869 bekannt. Aber erst die wissenschaftlichen Fortschritte im 20. Jahrhundert lassen die Zusammenhänge sichtbar werden: das Zeitalter der Gene beginnt. 1907 startet Thomas Hunt Morgan Züchtungsversuche an der Taufliege Drosophila. Morgan gelingt es zu zeigen, dass Gene, die sich entlang der Chromosomen aneinanderreihen, die Träger der Vererbung sind. Die Natur dieser „Gene“ ist zu diesem Zeitpunkt jedoch noch vollkommen unklar. Es dauert fast vierzig Jahre, bis der US-Amerikaner Oswald Avery nachweisen kann, dass die Weitergabe erblicher Information von einem Bakterien-Stamm auf einen anderen auf der Übertragung von DNA beruht. 1953 entwickeln James Watson und Francis Crick das Doppelhelix-Modell der DNA, bei dem sich zwei DNA-Fadenmoleküle schrauben förmig umeinanderwinden mit den Basenpaaren in der Mitte. Dieses Modell ist der Schlüssel zum Verständnis des genetischen Codes und bedeutet den Durchbruch für die genetische Forschung. Zusammen mit Maurice Wilkins erhalten die beiden Wissenschaftler dafür 1962 den Nobelpreis für Medizin.
Es hat also fast hundert Jahre gedauert, um die verschiedenen Puzzleteile zusammenzufügen. Wir wissen jetzt, dass die DNA die Basen Adenin, Thymin, Guanin und Cytosin enthält. Die Reihenfolge der Basen bedingt in verschlüsselter Form die Zusammensetzung der Proteine: Jeweils drei Basen der DNA bestimmen eine Aminosäure im Protein. Insgesamt kennt man zwanzig verschiedene Aminosäuren, die sich im menschlichen Körper zu Tausenden von Proteinen zusammenbauen lassen.
Die Suche nach dem Fehler
Proteine stellen die eigentlichen Bau- und Wirkstoffe der Zellen dar – sie bedingen am Ende die Eigenschaften, die das Leben ausmachen. Gene machen ihren Einfluss geltend, indem sie kontrollieren, welche Proteine zu welchem Zeitpunkt und an welchem Ort hergestellt werden. Sie steuern damit Zellverhalten und Entwicklung, das heißt, wie Zellen auf geordnete Weise verschieden werden. Wie das genau funktioniert, wollen Ende der 1970er Jahre Christiane Nüsslein-Volhard und Eric Wieschaus am Europäischen Laboratorium für Molekularbiologie (EMBL) in Heidelberg herausfinden. Systematisch suchen sie nach mutierten Genen, die auf die embryonale Entwicklung der Taufliege Drosophila einwirken. In umfangreichen Screenings erforschen sie die Nachkommenschaft Tausender einzelner Fliegen (Abb. A) unter dem Mikroskop, eine Sisyphus-Arbeit.
 [2]
[2]Abb. A: Der Schlüssel zum Verstehen. Eine der interessantesten Quellen zum Verständnis des menschlichen Genoms bietet der Vergleich mit dem Genom von Modellorganismen wie der Taufliege. Die Funktionen vieler Gene sind bei Drosophila nämlich aufgrund von Experimenten bekannt.
© Pavel Masek
Sie finden Fliegen, die an beiden Körperenden einen Kopf aufweisen, denen Brust- und Hinterleibssegmente fehlen oder die anstelle der Fühler ein Beinpaar auf dem Kopf tragen. Die Defekte lassen sich in drei Kategorien einteilen: sie beeinflussen entweder die Polarität, also die Ausrichtung des Embryos, seine Segmentierung oder die Positionierung von Strukturen innerhalb eines Segments. Die dreiteilige Klassifikation der Gene könnte, so die Hypothese, die schrittweise Verfeinerung des Körperbauplans in der frühen Embryogenese widerspiegeln. Bei ihren Arbeiten können sich die beiden Entwicklungsbiologen nur auf die beschreibende Analyse von Phänotypen stützen. Erst die molekularbiologischen Methoden der Genklonierung in den späten 1980er Jahren ermöglichen die Charakterisierung vieler Entwicklungsmutanten auf Molekülebene und erbringen schließlich den eindeutigen Beweis für die Richtigkeit der Hypothese. Ihre Ergebnisse markieren einen Wendepunkt in der Embryologie und werden deshalb 1995 mit dem Nobelpreis für Medizin ausgezeichnet.
Alles unter Kontrolle
Inzwischen sind etwa 150 entwicklungsregulierende Gene beschrieben worden, die die grobe Morphologie von Drosophila beeinflussen. Viele der Gene kodieren für sogenannte Transkriptionsfaktoren. Sie besitzen die Fähigkeit, im Zellkern an die DNA zu binden und so Gene an- oder abzuschalten. Auf diese Weise steuern Transkriptionsfaktoren die Produktion von Proteinen in der Zelle, die diese für die Wahrnehmung ihrer spezifischen Aufgaben benötigt. Nun ist nicht anzunehmen, dass die kleine Taufliege ein Patent für diesen Mechanismus der Entwicklungskontrolle besitzt. Forschende haben deshalb auch im Erbgut anderer Organismen nach Entwicklungskontrollgenen gefahndet: Im Genom von Wirbeltieren stoßen sie auf Sequenzbereiche, deren Sequenzen deckungsgleich mit den Entwicklungsgenen von Drosophila sind. Aus dieser strukturellen Homologie lässt sich aber nicht unmittelbar auch auf eine funktionelle Homologie schließen; denn entwicklungsgeschichtlich gesehen ist Drosophila ein Oldtimer. Die homologen Sequenzen könnten, obgleich noch strukturell bewahrt, ihre ursprüngliche Bedeutung längst verloren haben.
In einem Schlüsselexperiment können Peter Gruss und sein Team am Max-Planck-Institut für biophysikalische Chemie in Göttingen zeigen, dass Entwicklungskontrollgene von Drosophila auch bei der Maus funktionieren. Die molekularen Steuerungsmechanismen sind also über mehr als 600 Millionen Jahre der Evolution erhalten geblieben. Die Untersuchung von Genen mit Homologie zu Drosophila-Genen wird in den neunziger Jahren des 20. Jahrhunderts einer der erfolgreichsten Ansätze, um auch die Kontrolle der Entwicklung bei Wirbeltieren auf genetischem Niveau zu verstehen. Eine Voraussetzung für diese wegweisenden Experimente war die erfolgreiche Gewinnung und Kultivierung embryonaler Stammzellen bei der Maus.
Toti-, Pluri- und Multi-Talente
Was sind Stammzellen? Abhängig von der Säugetierart können bis zum 8-Zellstadium (nach drei Zellteilungen) die aus einer befruchteten Eizelle hervorgegangenen Tochterzellen, jede für sich alleine einen kompletten Organismus aufbauen. Sie sind totipotent. Zu späteren Stadien geht diese Fähigkeit jedoch allmählich verloren. Im sogenannten Blastozysten-Stadium besteht die innere Zellmasse, der Embryonalknoten, aus pluripotenten Stammzellen. Diese sind zwar nicht mehr totipotent, ihr Differenzierungspotenzial ist jedoch nach wie vor sehr groß. Aus diesen Vielkönnern entstehen im Verlauf der weiteren Embryonalentwicklung nämlich alle im Organismus benötigten Zelltypen. Aus dem Embryonalknoten lassen sich embryonale Stammzellen gewinnen. So werden pluripotente Stammzellen genannt, die als Zelllinie im Labor wachsen. Wie die pluripotenten Stammzellen in der Blastozyste können diese auch in der Kulturschale durch Zugabe bestimmter Wachstumsfaktoren alle Zelltypen des Körpers bilden.
Darüber hinaus finden sich in vielen Geweben des ausgewachsenen Organismus adulte Stammzellen. Sie sorgen für den gewebespezifischen Ersatz von ausgefallenen Zellen. So wird beispielsweise die Haut alle 28 Tage einmal „runderneuert“ – was nach einem Sonnenbrand durchaus hilfreich ist. Im Blut werden innerhalb von 24 Stunden mehrere Milliarden Zellen durch neue ersetzt und auch Muskelgewebe wird, beispielsweise nach Muskelabbau infolge eines Beinbruchs, regeneriert. Das Entwicklungspotenzial dieser Stammzellen gilt aber als eingeschränkt und man bezeichnet sie daher, je nachdem wie stark ihr Potential eingeschränkt ist, als multi- bzw. unipotent.
Streit um Stammzellen
1998 gelingt es dem US-Amerikaner James Thomson und seinem Team erstmals, auch aus menschlichen Embryonen pluripotente Stammzellen zu isolieren und durch Zugabe bestimmter Substanzen zum Nährmedium ihre weitere Ausdifferenzierung in Laborkultur zu verhindern. Über viele Jahre hinweg können so humane embryonale Stammzellen (hES) kultiviert werden und dabei ihre Pluripotenz erhalten, also ihre Fähigkeit, sich in eine Vielzahl von Zelltypen weiterzuentwickeln. Diese Ergebnisse nähren die Hoffnung, dass es gelingen könnte, beschädigte Gewebe mit Hilfe von Stammzellen zu ersetzen und somit Krankheiten wie Schlaganfall, Parkinson, Alzheimer, Osteoporose, Herzinfarkt oder Diabetes zu behandeln.
An einer Ausweitung der Forschung mit menschlichen embryonalen Stammzellen entzündet sich Ende der 1990er Jahre jedoch eine heftige Debatte. Ethisch umstritten ist vor allem die Herstellung der Zelllinien: Menschliche embryonale Stammzellen werden aus überzähligen Embryonen gewonnen, die im Rahmen von künstlichen Befruchtungen entstanden sind. In Deutschland ist die Gewinnung embryonaler Stammzellen aus menschlichen Embryonen verboten. Das 2001 beschlossene Stammzellgesetz erlaubt jedoch die Einfuhr und Verwendung solcher Stammzellen zu genehmigungspflichtigen Forschungszwecken. Mit der im Frühjahr 2008 beschlossenen Gesetzesnovelle wurde der Stichtag bezüglich der Herstellung humaner embryonaler Stammzelllinien verschoben. Seitdem dürfen nur solche Linien importiert werden, die vor dem 1. Mai 2007 gewonnen wurden.
A(du)lte Zellen reprogrammiert
Doch Wissenschaft steht nicht still und schickt sich an, auch als unverrückbar geglaubte Dogmen zu stürzen und so ganz neue Optionen zu eröffnen: 2006 gelingt es dem Japaner Shinya Yamanaka und seinem Team an der Universität Kyoto, Hautzellen einer Maus so umzuprogrammieren, dass sie sich wie embryonale Stammzellen verhalten. Ein Jahr später schaffen sie dieses Kunststück auch mit menschlichen Zellen – und kippen damit endgültig das uralte Dogma der Biologie, wonach spezialisierte Zellen nicht wieder in eine ursprüngliche Zelle umgewandelt werden können. Um die begehrten Multitalente zu erzeugen, haben die Japaner mithilfe viraler Genfähren vier Transkriptionsfaktoren mit den kryptischen Kürzeln Oct4, Sox2, Klf4 und cMyc in die Zellen eingeschleust – also jene entwicklungsregulierenden Gene, denen die Forscher schon länger auf der Spur sind. Die so entstandenen Zellen werden als induzierte pluripotente Stammzellen, kurz iPS bezeichnet (Abb. B). Weltweit gilt dies als detektivische Meisterleistung. Schließlich wusste bis dahin niemand, ob und wenn ja, mit welchen Faktoren sich eine Zelle überhaupt reprogrammieren lässt. 24 Kandidaten in allen erdenklichen Kombinationen testeten die Japaner, bis sie die richtige Kombination von vier Faktoren – salopp auch als Yamanaka-Cocktail bezeichnet – gefunden hatten, mit der genau jene Gene angeschaltet und abgelesen werden, die zur Pluripotenz führen. Für diesen wissenschaftlichen Durchbruch erhält Shinya Yamanaka bereits sechs Jahre später, im Jahre 2012, den Nobelpreis für Medizin.
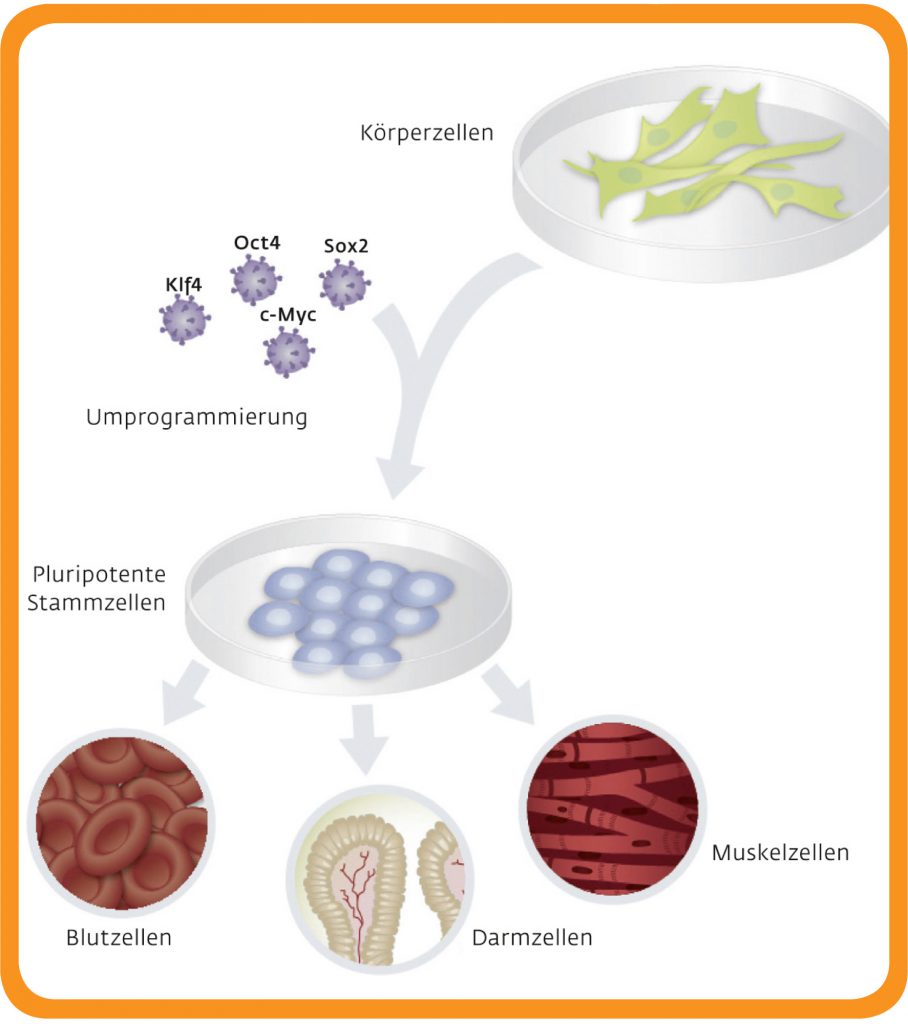 [3]
[3]Abb. B: Vom Spezialisten zum Alleskönner. Die Zugabe von vier Wachstumsfaktoren reicht aus, um aus Körperzellen wieder Alleskönner-Zellen zu machen. Diese pluripotenten Stammzellen sind in der Lage, sich zu einem beliebigen Zelltyp weiterzuentwickeln.
© University of Utah
2009 gelingt es dem Team um Hans Schöler, Direktor am Max-Planck-Institut für molekulare Biomedizin in Münster, adulte Stammzellen aus dem Gehirn von Mäusen durch Zufügen eines einzigen Transkriptionsfaktors, des Oct4, in induzierte pluripotente Stammzellen (iPS-Zellen) umzuwandeln – sie brauchen lediglich etwas mehr Geduld, bis der Prozess der Reprogrammierung abgeschlossen ist. Oct4 scheint dabei eine Schlüsselrolle zu spielen: „Das Gen ist in allen pluripotenten Zellen des Embryos aktiv“, sagt Schöler. Dabei regulieren sich Oct4, Sox2 und zahlreiche andere Gene bzw. Proteine gegenseitig. Wie genau, wird immer noch in zahlreichen Laboren untersucht. Und wie so oft sind die Zusammenhänge komplizierter als ursprünglich gedacht. So haben Schöler und sein Team inzwischen herausgefunden hat, dass Oct4 für die ersten einleitenden Schritte von Pluripotenz gar nicht benötigt wird – weder in der sich entwickelnden Maus noch bei der Reprogrammierung. Ohne Oct4 ist Pluripotenz allerdings auch nicht möglich: „Es wird dann essenziell, wenn die Pluripotenz von Zellen aufrechterhalten werden muss“, erklärt Schöler.
Ersatzteillager bald praxistauglich?
Die Reprogrammierung von menschlichen Körperzellen zu humanen iPS-Zellen (hiPS) stellt nicht nur einen Durchbruch für die Forschung dar, sondern hat auch die teilweise sehr erhitzte Debatte um embryonale Stammzellen beruhigt. Dazu kommt, dass die Reprogrammierungs-Technik durch weitere Forschungen in rasantem Tempo praxisfreundlicher wird. So gelang es dem Max-Planck-Team zusammen mit kalifornischen Wissenschaftlerinnen und Wissenschaftlern Zellen ohne virale Gen-Fähren in iPS-Zellen umzuwandeln. Dazu schleusten sie die entsprechenden Proteine direkt in die Hautzellen von Mäusen ein. „Das ist nicht trivial, denn zumindest im molekularen Maßstab sind Proteine extrem groß“, so Schöler. Doch ein Trick half: Sie koppelten eine kleine Kette aus Bausteinen der Aminosäure Arginin an die zuvor eigens in Bakterien hergestellten Proteine. Dieses molekulare Zugangsticket erleichtert deren Eintritt in die Zellen. Die Zugabe der Proteine birgt nach heutigen Kenntnissen kein Risiko – auch weil sie im Inneren der Zelle recht schnell abgebaut werden. „piPS-Zellen“ haben die Forscher ihre neuen Kreationen getauft: Protein induzierte pluripotente Stammzellen. Inzwischen haben andere Labore auch Verfahren entwickelt, die die chemische Reprogrammierung von iPS-Zellen („ciPS-Zellen“) erlauben. Vor dem Hintergrund einer therapeutischen Anwendung am Menschen scheint damit eines der Kernprobleme der Zell-Reprogrammierung gelöst. „Wir haben jetzt den Fuß in der Tür, aber die Verfahren müssen noch wesentlich effizienter werden“, betont Schöler. Die Hoffnung der Forschenden ist zumindest rein technisch gesehen nicht mehr utopisch: Sie wollen Patienten mit Herzinfarkt, Diabetes, Parkinson oder anderen Erkrankungen eines Tages Zellen entnehmen, sie in iPS-Zellen umprogrammieren und diese dann wiederum in die gewünschten Zelltypen umwandeln, um das kranke oder verletzte Gewebe durch frische und vitale Zellen zu ersetzen. Damit gäbe es dann endlich das gewünschte Ersatzteillager aus Zellen, die vom Patienten selbst stammen und von seinem Immunsystem nicht abgestoßen werden. Tatsächlich hat die US-Gesundheitsbehörde FDA mittlerweile grünes Licht für den Start einer klinische Phase-I-Studie gegeben, die aus pluripotenten Stammzellen gewonnene Dopamin-Neurone für die Behandlung der fortgeschrittenen Parkinson-Krankheit nutzen will.
Der Jungbrunnen – ein Menschheitstraum
Inzwischen denken Wissenschaftlerinnen und Wissenschaftler darüber nach, wie man Zellen direkt im Körper reprogrammieren kann. Gerade der Verlust an Stammzellen im gealterten Körper macht solche Überlegungen attraktiv. Wie schön und gesundheitlich wichtig wäre es, wenn man im Alter noch genug Kraft in den Armen und Beinen hätte. Als Modellsystem nutzen Forscher u.a. sogenannte menschliche Organoide, das sind aus Stammzellen abgeleitete Organ-ähnliche Strukturen (Abb. C).
 [4]
[4]Abb. C: Organ-Modelle der Zukunft. Gehirn-Organoide in der Petrischale. Mit zunehmenden Alter wird die Komplexität der Organoide größer. Zu Beginn bestehen sie aus neuralen Stamm- und Vorläuferzellen. Nach 70 Tagen dominieren reife und junge Nervenzellen sowie Gliazellen. © T. Rauen, MPI für molekulare Biomedizin
Das Team um Hans Schöler setzt beispielsweise Gehirnorganoide ein, um einerseits Medikamente gegen Parkinson zu finden, andererseits um Verfahren der „Zellverjüngung“ direkt im Körper zu entwickeln. Ein wichtiges Hilfsmittel dazu ist das von ihnen im Jahr 2020 publizierte vollautomatisierte Verfahren der Organoid-Züchtung. Die uralte Vision eines „Jungbrunnens“ könnte so vielleicht doch noch Wirklichkeit werden.
Abbildungshinweise:
Titelbild: © freshidea / Adobe Stock
Abb. A: Drosophila © Pavel Masek
Abb. B: Vom Spezialiste zum Alleskönner © University of Utah
Abb. C: Organ-Modelle der Zukunft © T. Rauen, MPI für molekulare Biomedizin
Der Text wird unter CC BY-NC-SA 4.0 [5] veröffentlicht.
BIOMAX 10, Neuauflage Herbst 2021; Text: Christina Beck; Redaktion: Tanja Fendt